S1P-Rezeptor-Modulatoren Was die Daten abseits der MS hergeben
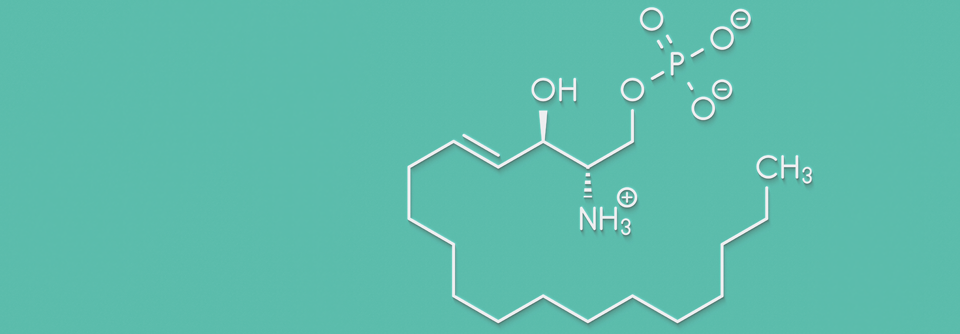 S1P: Darstellung des Molekülgerüsts.
© molekuul.be – stock.adobe.com
S1P: Darstellung des Molekülgerüsts.
© molekuul.be – stock.adobe.com
Sphingosin-1-Phosphat (S1P) ist als Signalmolekül u.a. an der Migration von Lymphozyten, der Entwicklung des Gehirns und des Herzens, der Durchlässigkeit von Gefäßen sowie der Regulierung des Tonus von Gefäßen und Bronchien beteiligt. Dabei wirkt S1P über eine Reihe von membranständigen S1P-Rezeptor-Subtypen (S1PR1, 2, 3, 4, 5), die variable organ- und zell-spezifische Expressionsmuster aufweisen und somit unterschiedliche Funktionen haben.
| Die S1P-Rezeptor-Subtypen | |||||
|---|---|---|---|---|---|
| S1PR1 | S1PR2 | S1PR3 | S1PR4 | S1PR5 | |
| Ort der Expression | Gehirn, Herz, Milz, Leber, Lunge, Niere, Skelettmuskel, Thymus | Lunge, Lymphsystem | Gehirn, Milz, Haut | ||
| Lymphsystem | Hoden | ||||
| spielt eine Rolle bei | Migration von Immunzellen, Degranulation von Mastzellen, Angiogenese, Neurogenese, endotheliale Barrierefunktion, Regulation der Herzfrequenz, Funktion glatter Muskelzellen, Aktivierung und Proliferation von Glia und Astrozyten, Funktion der Bluthirnschranke | Migration von Immunzellen, Degranulation von Mastzellen, Integrität der endothelialen Barriere, Funktion glatter Muskelzellen, Entwicklung und Überleben der Haarzellen im Innenohr | Migration von Immunzellen, Barrierefunktion vom Endothel, Funktion glatter Muskelzellen, Regulation der Herzfrequenz | Migration von Immunzellen, Sekretion von T-Zell-Zytokinen, Funktion der glatten Muskelzellen in den Bronchien | Migration natürlicher Killerzellen, Überleben von Oligodendrozyten. |
S1P-Gradient spielt wesentliche Rolle
Damit könnten sich therapeutische Angriffspunkte für eine ganze Reihe von Krankheiten bieten, schreiben Dr. Marisa McGinley und Dr. Jeffrey Cohen vom Mellen Center der Cleveland Clinic. Die verfügbaren Daten dazu haben die beiden nun durchforstet.
Mit Blick auf immunologische Prozesse ist ein S1P-Gradient zentral daran beteiligt, dass bestimmte T- sowie B-Zellen dem Gradienten folgend die Lymphknoten verlassen. Bei den S1P-Modulatoren, die gegen die Multiple Sklerose eingesetzt werden, handelt es sich um small molecules, die an S1PR1 auf den Lymphozyten binden und zu einer Internalisierung des Rezeptors führen. Man geht davon aus, dass es in der Folge zu einem Verlust der Empfindlichkeit auf den S1P-Gradienten kommt, wodurch die Lymphozyten in den Lymphknoten verbleiben. Ihre zirkulierende Zahl sinkt und die inflammatorische Zellmigration ins zentrale Nervensystem nimmt ab. Darüber hinaus sind möglicherweise direkte Effekte der S1PR-Modulatoren auf die Bluthirnschranke, Astrozyten und Oligodendrozyten relevant.
Bis heute wurden mit Fingolimod, Siponimod, Ozanimod und Ponesimod vier Vertreter dieser Klasse für die MS-Therapie zugelassen, wobei Fingolimod die breiteste Rezeptoraffinität (S1PR1, 3, 4, 5) hat. Siponimod und Ozanimod modulieren selektiv S1PR1 und 5, Ponesimod spezifisch S1PR1.
Auftitrieren beugt Herzrhythmusstörungen vor
Die Tatsache, dass S1P-Rezeptoren an so zahlreichen Signalwegen mitwirken, erklärt eine Reihe der Nebenwirkungen, die bei der Therapie der MS auftreten können. Dies war auch der Grund, warum bei der Entwicklung der neueren Substanzen auf eine höhere Rezeptorspezifität geachtet wurde. Für die Praxis hat insbesondere die Verlangsamung der Herzfrequenz und der atrioventrikulären Überleitung zu Beginn der Behandlung Relevanz. Diesem Effekt wirkt man bei den jüngeren Substanzen mit einem Auftitrierungsschema über mehrere Tage entgegen.
Jenseits der Multiplen Sklerose wurden und werden S1PR-Modulatoren in einer Reihe von weiteren Indikationen untersucht: Bei der Nierentransplantation, der ersten Indikation für einen S1PR-Modulator überhaupt, erwies sich Fingolimod gegen die Abstoßung zwar als wirksam. Es war aber nicht effektiver als bereits verfügbare Optionen, hatte aber mehr Nebenwirkungen.
Nach ersten vielversprechenden Daten gibt es aktuell weitere Studien zu chronisch-entzündlichen Darmerkrankungen, Hirnblutungen und ischämischen Schlaganfällen. Positive Studienergebnisse liegen auch für den systemischem Lupus erythematodes, die Psoriasis und die COVID-19-Pneumonie vor. Frühe Studien beim Menschen laufen zudem zur durch Chemotherapie induzierten Neuropathie.
Von Studien zum Rett-Syndrom und hochmalignem Gliom wurden keine Ergebnisse veröffentlicht. Nicht erfolgreich verliefen Untersuchungen zu chronischer inflammatorischer demyelinisierender Polyradikuloneuropathie, amyotropher Lateralsklerose, Schizophrenie und Asthma.
Präklinische Forschung findet zu einer noch weitaus größeren Anzahl an Indikationen statt. Andere Mitglieder des S1P-Signalwegs wie S1P selbst kommen ebenfalls als therapeutische Zielstrukturen infrage und werden als solche untersucht.
Quelle: McGinley MP, Cohen JA. Lancet 2021; DOI: 10.1016/S0140-6736(21)00244-0