Gerät statt Spenderherz
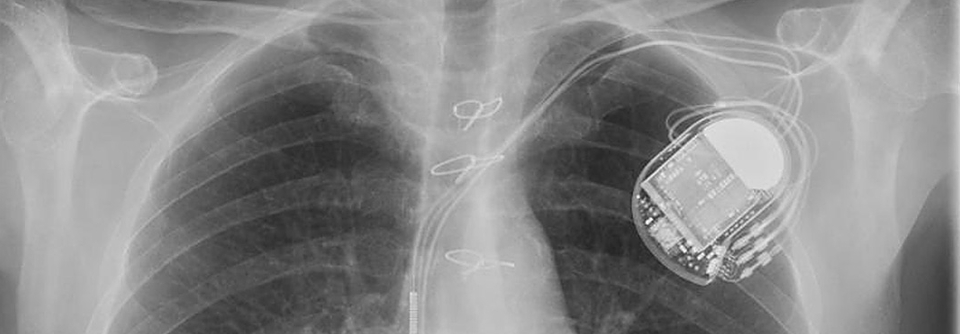
 Diese Thoraxaufnahme zeigt das implantierte LVAD einer 65-jährigen Patientin mit Herzinsuffizienz.
© Science Photo Library/Zephyr
Diese Thoraxaufnahme zeigt das implantierte LVAD einer 65-jährigen Patientin mit Herzinsuffizienz.
© Science Photo Library/Zephyr
In erster Linie kommen zur Kammerunterstützung linksventrikuläre Systeme (left ventricular assist device, LVAD) zum Einsatz. Etwa 900 dieser Geräte werden pro Jahr in Deutschland implantiert und halten bis zu zehn Jahre, berichtete PD Dr. Gloria Färber von der Klinik für Herz- und Thoraxchirurgie am Universitätsklinikum Jena. LVAD bringen einen erheblichen Gewinn an Lebenszeit gegenüber einer konservativen Therapie. Hinsichtlich des Zwei-Jahres-Überlebens stehen sie den Erwartungen nach einer Transplantation kaum nach (70 % bzw. ca. 75 %).
Mit Unterstützungssystem, aber ohne Puls
Ein LVAD wird in Parallelschaltung zum vorhandenen Organ an der Spitze angeschlossen und befördert das Blut vom linken Ventrikel in die Aorta ascendens. Das eigene Herz kann trotz der Unterstützung weiterschlagen. Auf dem Markt sind verschiedene Systeme, hierzulande hat aber fast nur noch das HeartMate 3 Relevanz, stellte Dr. Färber fest. Es erzielt bei kontinuierlichem Fluss ein Herzzeitvolumen von bis zu 10 l/min. Dank eines innovativen Pumpenaufbaus entstehen weniger Blutzelltraumata als mit Vorgängermodellen. „Den vom Gerät erzeugten Puls spürt man nicht, d.h. die Träger sind pulslos – es sei denn, sie haben noch eine gute Eigenleistung“, erklärte die Ärztin. Dies führt u.a. dazu, dass sich über einen Sättigungsclip kaum etwas ableiten lässt. Die Patienten benötigen eine lebenslange Antikoagulation mit Phenprocoumon (Ziel-INR 2–2,5) und ASS 100 mg täglich.
Zum System gehört externes Zubehör. Dieses umfasst eine Steuereinheit (Controller), die akustische und visuelle Alarme geben kann, wiederaufladbare Batterien und alternativ eine Stromeinheit für den Direktanschluss an die Steckdose. Als Verbindung zwischen Controller und Pumpe fungiert ein Kabel. Diese Driveline ist gleichzeitig die „Lifeline“, denn wird sie durchtrennt, steht die Pumpe still. Gleichzeitig stellt die Driveline die technische Achillesferse dar, hier kann es zu Infektionen oder Kabelbruch kommen.
Der Ersatzakku sollte immer griffbereit sein
Im Alltag drohen den Patienten Gefahren durch Medikamente z.B. im Rahmen einer schlecht eingestellten Antikoagulation, aber auch durch riskante Wasser- und Kampfsportarten. Ein unsachgemäßer Umgang mit dem Gerät (mangelnde Hygiene, UV-Einstrahlung etc.) wird ebenfalls rasch lebensbedrohlich. Auch sollten Patienten für den Fall gewappnet sein, dass ein unvorhergesehenes Ereignis (z.B. Verkehrsstau) den Zeitplan durcheinander bringt und die Akkus leer laufen.
Zu den systemspezifischen Komplikationen gehört die Pumpenthrombose, die sich akut oder schleichend entwickeln kann. Sie bewirkt, dass die Pumpe immer mehr Strom braucht und allmählich zum Stehen kommt. Typische Anzeichen sind Dyspnoe, Müdigkeit, Hämaturie, LDH-Erhöhung und dunkler Urin. Als Folgen kommen Tachykardie, Nierenversagen und die wieder einsetzende Herzinsuffizienz in Betracht. Am Gerät zeigt die Alarmhistorie einen reduzierten Pumpendurchfluss an. Zur Diagnose hilft echokardiographisch der Ramp-Test: Bei Pumpenthrombose ruft die Erhöhung der Drehzahl im Ventrikeldurchmesser keine adäquate Antwort mehr hervor. Ansonsten sind Angio oder CT indiziert, als Therapie schließen sich Lyse oder Pumpentausch an.
Bewusstlose LVAD-Träger richtig erstversorgen
Ist ein Patient mit LVAD bewusstlos, prüft man zunächst alle technischen Einheiten und checkt den Controller, der bereits relativ viele Daten liefert. Er informiert meist auch darüber, was zu tun ist. Die wichtigste Anweisung lautet in der Regel: im VAD-Zentrum anrufen. Erst dann folgt das klinische Assessment. Denn nicht immer liegt es an der Pumpe, es kann auch ein Schlaganfall oder eine Hypoglykämie dahinterstecken.
70 % aller Komplikationen ereignen sich im ersten Jahr, die Top 3 der Todesursachen sind Infektion, Rechtsherzversagen und Schlaganfall. Blutungen haben eine Inzidenz von 9–22 %.
Es kann zudem zu einem Ansaugen kommen: Der linke Ventrikel wird leer gesaugt, während der rechte überläuft. Dies zieht oft Arrhythmien nach sich, die aber genauso gut ohne Ansaugen entstehen können und dann leitliniengerecht behandelt werden.
Reanimation und Defibrillation sind mit liegendem Gerät möglich. Allerdings muss man bei der Wiederbelebung mit einem Rückfluss aus der Aorta in den linken Ventrikel rechnen. Dieser beträgt ungefähr ein bis zwei Liter, sofern die Pumpe komplett stillsteht, d.h. die Reanimation ist nicht so effizient wie in anderen Fällen.
Quelle: 88. Jahrestagung der DGK*
* Deutsche Gesellschaft für Kardiologie
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).