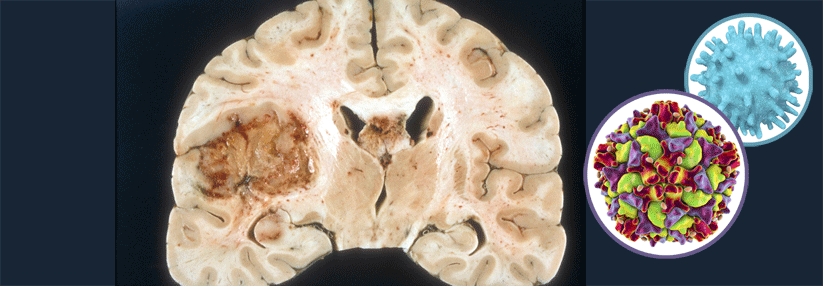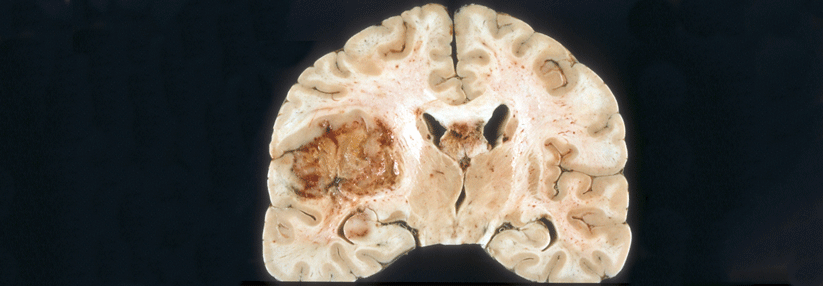
Trotz neuer Entwicklungen bislang kein verlängertes Überleben
Der Einsatz von antikörpergekoppelten Immuntherapeutika wird in der Neuroonkologie durch mehrere Umstände erschwert, erinnerte Prof. Dr. Patrick Roth vom Universitätsspital Zürich. So gebe es in Glioblastomen keine wirklich tumorspezifischen Antigene und bei den überexprimierten Zielen entstehen „on-target“-, aber „off-tumor“-Toxizitäten. Hinzu kommen z.B. der erschwerte Zugang durch die Blut-Hirn-Schranke, die immunsuppressive Mikroumgebung, und dass Patienten häufig zusätzlich entzündungshemmende Steroide erhalten.
Das bekannteste Antikörper-Wirkstoff-Konjugat, das in den vergangenen Jahren eine fortgeschrittene klinische Phase erreichte, sei Depatuxizumab-Mafodotin (Depatux-M), berichtete der Referent. Die Substanz richtet sich spezifisch gegen überexprimierte, aktive bzw. mutierte Formen des EGF-Rezeptors. Als Fusionspartner dient das Toxin Monomethylauristatin F. In einer frühen klinischen Studie zum Glioblastom war Depatux-M zunächst wirksam – allerdings nur in Kombination mit Temozolomid.
In der anschließenden Phase-3-Studie bestätigte sich dies jedoch nicht. Zwar seien die Daten nicht vollständig vorgestellt worden, so Prof. Roth, doch laut dem Hersteller verlängerte die Behandlung das Gesamtüberleben nicht, der primäre Endpunkt wurde damit nicht erreicht und das Medikament nicht weiter entwickelt.
Kalten Tumoren einheizen mit TNF-α-Konjugationen
Ein zweites Fusionskonstrukt, mit dem Forscher gegen das Glioblastom vorgehen wollten, war Bintrafusp alfa. Dessen Antikörper erkennt PD-L1, fungiert also als Checkpoint-Inhibitor. Zusätzlich enthält das Konjugat eine TGF-β-Falle. So sollte es zwei starke immunsuppressive Signalwege gleichzeitig blockieren. Vor wenigen Monaten sei präklinisch gezeigt worden, dass Bintrafusp alfa das OS in einem Gliom-Mausmodell verlängerte und ein Synergismus mit Bestrahlung existiert, berichtete der Referent. Aktuelle Ergebnisse einer ersten klinischen Studie ließen allerdings bezweifeln, ob das Medikament tatsächlich zu einem Überlebensvorteil beim Glioblastom (nach seiner heutigen Definition) führt. Zudem habe der Hersteller kürzlich mitgeteilt, dass ein neues Sicherheitssignal aufgetreten sei. Ob Bintrafusp alfa für das Glioblastom weiter entwickelt werde, sei daher fraglich.
Der Ansatz, den Prof. Roth mit seiner Arbeitsgruppe verfolgt, beruht auf der Idee, die immunologisch kalten Glioblastome in heiße Tumoren umzuwandeln. An einen Antikörper, der eine tumorspezifische Variante von Fibronektin erkennt, koppelten die Forscher pro-inflammatorische Zytokine. Das aktuell aussichtsreichste Konjugat L19-TNF mit TNF-α als Zytokin könnte zudem eine Tumornekrose auslösen. Im Tiermodell erreichte die Substanz ihr Ziel im Gehirn, zwei Drittel der Mäuse lebten länger. Mit mehreren Zusatzbehandlungen ergab sich ein additiver oder synergistischer Nutzen. L19-TNF wird mittlerweile in drei klinischen Studien erprobt, zwei davon in rezidivierten Glioblastomen, eine in der Erstlinie zusätzlich zum Standard.
Gegen klinische Misserfolge: biologisch genauer hinsehen
Erste Daten weisen darauf hin, dass sich die Form der Tumoren nach Gabe von L19-TNF ändert, mehr Nekrosen auftreten und die Perfusion im Krebs sinkt. Histologien von Patienten mit einer zweiten Resektion wiesen eine erhöhte Infiltration mit CD4+ und CD8+ T-Zellen auf.
In Zukunft sollte zu Beginn der klinischen Erprobung mehr auf biologische Endpunkte gesetzt werden, betonte Prof. Roth. So ließe sich vermeiden, dass Medikamente, die später keinen Nutzen zeigen, bis in klinische Phasen entwickelt werden und Hunderte Erkrankte sie erhalten. Es sei wichtig, in Gewebeproben nachzuweisen, dass die Therapie den Tumor in ausreichender Menge erreicht, und dass sie dort auch wirkt. Das gelte für Antikörperkonjugate und alle neuen Substanzen in der Neuroonkologie.
Quelle: Roth P et al. ESMO Immuno-Oncology Congress 2021; Session: New indications in CNS tumours
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).