Nivolumab wirkungslos beim rezidivierten Glioblastom
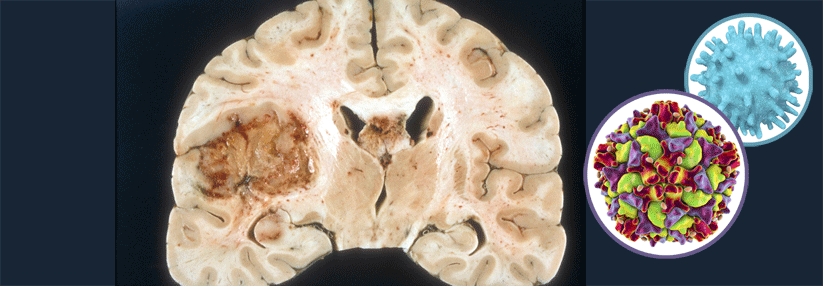
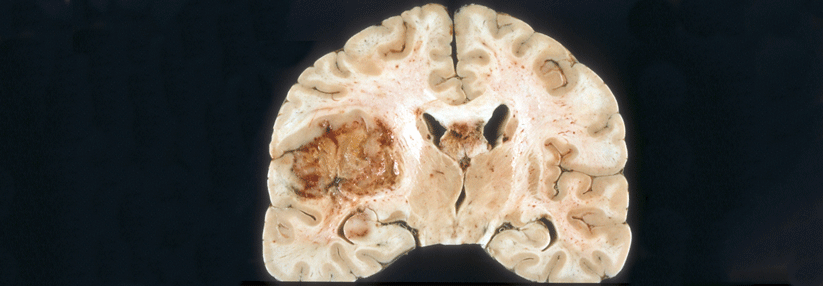
 Glioblastome sind die häufigsten hirneigenen Neoplasien. In der Regel erkranken Patienten zwischen dem 45. und 60. Lebensjahr.
© Science Photo Library/Marazzi, Dr. P.
Glioblastome sind die häufigsten hirneigenen Neoplasien. In der Regel erkranken Patienten zwischen dem 45. und 60. Lebensjahr.
© Science Photo Library/Marazzi, Dr. P.
Das Glioblastoma multiforme hat nach wie vor eine ausgesprochen schlechte Prognose. Nur weniger als 10 % der Erkrankten überleben nach der Diagnosestellung die nächsten fünf Jahre. Die Erstlinientherapie erfolgt abhängig vom EORTC(European Organisation for Research and Treatment of Cancer)-Protokoll. Einer möglichst radikalen Operation folgt eine Radiatio sowie eine Chemotherapie mit Temozolomid. Ein Rezidiv ist aber in nahezu allen Fällen zu erwarten und limitiert die weiteren Optionen.
Eine Phase-1-Studie hatte zuvor die Sicherheit belegt
Bisher hat keine Behandlung es geschafft, das Überleben zu verlängern. Das gilt auch für den PD1-Inhibitor Nivolumab, den Forscher um Professor Dr. David A. Reardon vom Center for Neuro-Oncology des Dana-Farber Cancer Institute in Boston in der Phase-3-Studie CheckMate 143 bei Temozolomid-rezidiviertem Glioblastom mit Bevacizumab verglichen.
Präklinische Untersuchungen ließen vermuten, dass Immunzellen die Blut-Hirn-Schranke passieren und den Tumor angreifen könnten. In Tierversuchen schien eine Checkpoint-Blockade vielversprechend. Nachdem eine Phase-1-Studie die Sicherheit von Nivolumab in dieser Situation bestätigt hatte, rekrutierten Wissenschaflter in 57 Zentren aus zwölf Ländern Patienten mit einem erstmals rezidivierten Glioblastom. Von den 369 Teilnehmern erhielten randomisiert 184 Patienten 3 mg/kgKG Nivolumab und 185 Erkrankte 10 mg/kgKG Bevacizumab alle zwei Wochen bis zum Auftreten einer Progression, inakzeptabler Toxizitäten oder eines Todesfalls.
Der primäre Endpunkt, das Gesamtüberleben, ergab nach median 9,5 Monaten Nachbeobachtungszeit keinen Unterschied zwischen den Gruppen. Unter Nivolumab lag die mediane Überlebensdauer bei 9,8 Monaten, unter Bevacizumab bei 10,0 Monaten (Hazard Ratio 1,04; p = 0,76). In beiden Armen waren nach einem Jahr noch 42 % der Patienten am Leben. In puncto Gesamtansprechrate zeigte der VEGF-Antikörper seine Überlegenheit mit 23,1 % gegenüber nur 7,8 % mit dem PD1-Inhibitor.
Die Behandlung brachen 95 % der Personen im Nivolumab- und 85 % derer im Bevacizumab-Arm ab. Meist lagen der Entscheidung eine Progression oder therapiebedingte unerwünschte Ereignisse zugrunde. Dennoch stufen die Autoren die Therapie als sicher ein. Nebenwirkungen von Grad 3–4 entwickelten 18,1 % der Patienten unter Nivolumab und 15,2 % unter Bevacizumab. Keine Todesfälle konnten auf den Antikörper bzw. den Inhibitor zurückgeführt werden.
Rund 23 % der Teilnehmer in beiden Gruppen wiesen im Tumorgewebe eine Methylierung des Genpromoters der O6-Methylguanin-DNA-Methyltransferase (MGMT) auf. Diese Methylierung spricht für ein günstigeres Ansprechen auf die Chemotherapie mit Temozolomid.
Nur eine kleine Subgruppe schien zu profitieren
In einer Subgruppenanalyse schienen Patienten mit methyliertem MGMT-Promoter unter Nivolumab eine bessere Prognose zu haben, insbesondere wenn sie zuvor keine Kortikosteroide erhalten hatten. Für Bevacizumab ergab sich zwar auch tendenziell eine günstigere Prognose, jedoch unabhängig der Steroideinnahme. Aufgrund der geringen Personenzahl in der Subgruppe muss die Annahme in weiteren Studien überprüft werden, fordern die Autoren.
Anders sehen das Dr. Alexandra M. Miller und Lisa M. DeAngelis vom Memorial Sloan Kettering, New York. Denn der Vorteil für Patienten mit methyliertem MGMT und ohne Kortikosteroidgabe fiel gering aus. Sie warnen davor, in Post-hoc-Analysen die Wirkung untersuchter Therapien auf Subgruppen überzubewerten. Dies sei nicht selten der Fall. Zeit und Geld für weiterführende randomisierte Studien könne man sich demnach oft sparen.
Auch kritisieren sie, dass die CheckMate-143-Studie überhaupt durchgeführt wurde. Schließlich würden viele Patientenmerkmale bereits gegen die Wirksamkeit von PD1-Inhibitoren bei rezidivierten Glioblastomen sprechen und in früheren Studien sei es ebenfalls nicht gelungen, einen eindeutigen Vorteil zu belegen.
Die beiden Neuro-Onkologinnen erachten es demnach als bewiesen, dass eine Monotherapie mit einem PD1-Inhibitor für das rezidivierte Glioblastom keine Wirkung erzielt. Vielmehr fordern sie Wissenschaftler dazu auf, Grundlagenforschung beim Glioblastom zu betreiben. Nur so könne man neue Ansätze für Therapien finden, denn diese Entität würde sich meist nicht so verhalten wie andere Karzinome.
Quellen:
1. Reardon DA et al. JAMA Oncol 2020; 6: 1003-1010; DOI: 10.1001/jamaoncol.2020.1024
2. Miller AM, DeAngelis LM. A.o.O.; 323: 2482-2484; DOI: 10.1001/jama.2020.5934
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).