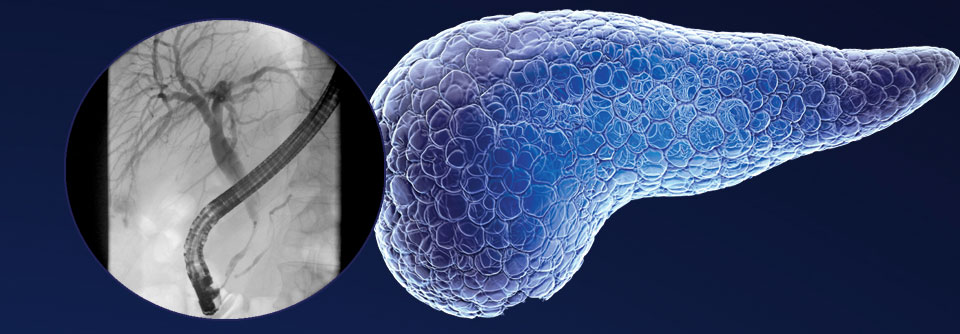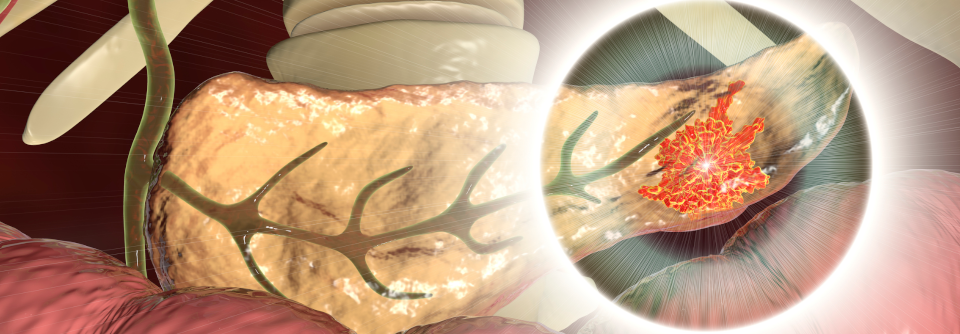
Lungenmetastasen bei Pankreaskrebs ... und da waren es plötzlich weniger
 Das metastasierte Pankreaskarzinom wird mit den genmanipulierten T-Lymphozyten höchst personalisiert in Angriff genommen.
© Icruci – stock.adobe.com
Das metastasierte Pankreaskarzinom wird mit den genmanipulierten T-Lymphozyten höchst personalisiert in Angriff genommen.
© Icruci – stock.adobe.com
Auch beim Pankreaskarzinom gibt es „Hotspot“-Mutationen, die sich als Angriffspunkte für spezifische Immunzellen eignen. Die G12D-Punktmutation im KRAS-Onkogen etwa findet sich auch in kolorektalen Karzinomen. Amerikanische Kolleg:innen um Dr. Rom Leidner, Providence Cancer Institute Franz Clinic, Portland, hatten in den tumorinfiltrierenden Lymphozyten einer Frau mit metastasiertem CRC T-Zellen entdeckt, die KRASG12D erkennen und eine Restriktion für den HLA-C-Subtyp 08:02 aufwiesen.1 Die Behandlung mit den autologen KRASG12D-reaktiven Lymphozyten führte zu einer objektiven Rückbildung der viszeralen Metastasierung, weshalb die Autor:innen den gleichen Ansatz bei einer 71-jährigen…
Bitte geben Sie Ihren Benutzernamen und Ihr Passwort ein, um sich an der Website anzumelden.