Rheuma Prä-RA, Interleukin-40 und Mastzellen im Fokus der Wissenschaft
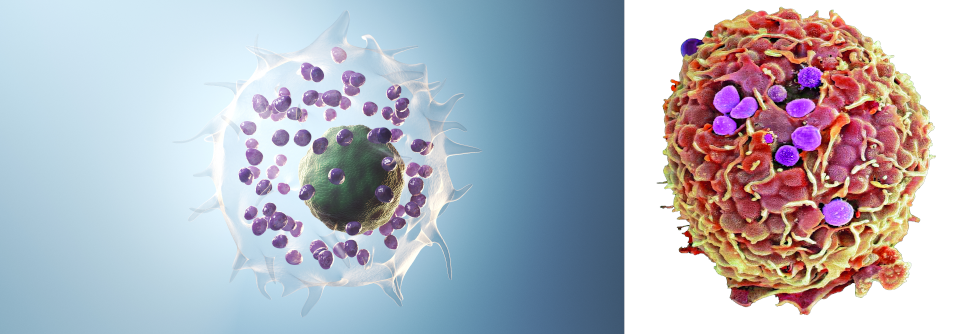
 Osteoklasten (rot) auf der Oberfläche eines Knochens (Illustration).
© Science Photo Library/Hybrid Medical Animation
Osteoklasten (rot) auf der Oberfläche eines Knochens (Illustration).
© Science Photo Library/Hybrid Medical Animation
Seit Kurzem gibt es Hinweise darauf, dass die seronegative rheumatoide Arthritis (RA) womöglich gar nicht seronegativ ist. In einer großen chinesischen Kohorte von Patienten mit ACPA-negativer RA konnten neun neue Antikörper identifiziert und durch Mikroarrays bestätigt werden, berichtete Prof. Dr. Ulf Müller-Ladner von der Kerckhoff-Klinik Bad Nauheim.
Zwei davon sind besonders relevant: Anti-PTX3, ein Immunglobulin gegen einen löslichen Rezeptor des angeborenen Immunsystems, und Anti-DUSP11, ein Antikörper gegen eine RNA-Phosphatase, die verschiedene Signalwege hemmt. Jeweils etwa ein Drittel der seronegativen RA-Patienten wies einen dieser beiden Antikörper auf. Kombiniert man sie, liegt ihre diagnostische Sensitivität für eine RA bei 38 %, die Spezifität bei 89 %, unabhängig vom ACPA-Status.
Fazit von Prof. Müller-Ladner: Es gibt möglicherweise eine seropositive Welt außerhalb von Rheumafaktor und ACPA.
Amerikanische Wissenschaftler begaben sich auf die Suche nach Veränderungen im Serumproteom vor der klinischen Manifestation einer RA. Aus einer Kohorte von Verwandten ersten Grades indigener nordamerikanischer RA-Patienten konnten sie 17 Teilnehmer bis zum Beginn ihrer RA hinsichtlich ihrer Proteomsignaturen molekularbiologisch überwachen. Unabhängig vom Antikörperstatus zeigte sich bei diesen Personen eine prädiktive präklinische Signatur in den Serumproben – und zwar im Median schon 31 Monate vor dem Ausbruch der Erkrankung. Damit ist die Vorlaufstrecke der RA wohl länger als bisher vermutet. „Und irgendwann kippt es“, sagte Prof. Müller-Ladner. Interessanterweise handelte es sich nicht um unbekannte oder exotische Proteine. Der klinisch manifesten RA ging die Aktivierung des Toll-like Rezeptors 2 sowie die Synthese von Tumornekrosefaktor und Interleukin-1 voraus. Also genau die Signatur, die man später mit TNF-Blockern und IL-1-Rezeptor-Antagonisten behandelt.
Ein neues Zytokin konnte Prof. Müller-Ladner ebenfalls vorstellen: Interleukin-40. Es ist an der humoralen Immunantwort und der B-Zell-Homöostase beteiligt. IL-40 kommt in Serum und Synovialflüssigkeit vor und ist assoziiert mit Interleukin-8 und dem Chemokin MIP-1alpha. Biologika wirken unterschiedlich auf die IL-40-Spiegel. So führten in einer Gruppe von RA-Patienten Rituximab und TNF-Blocker zu einer deutlichen Reduktion des DAS28. Parallel dazu sanken die Serumspiegel von IL-40 unter Rituximab, nicht aber unter dem TNF-Blocker. Mit IL-40 gibt es nun ein neues Markermolekül für die B-Zell-Aktivität, resümierte Prof. Müller-Ladner – auch wenn es noch nicht für die Klinik geeignet ist.
Ein neuer Player namens Interleukin-40
Spannende Erkenntnisse bringt auch die Mastzellforschung. Diese Zellen finden sich bei der RA zwar nur in relativ geringer Zahl in Synovialgewebe und -flüssigkeit, können aber im Zusammenspiel mit Interleukin-33 einigen Schaden anrichten. IL-33 stimuliert dabei nicht nur die Expression von Tryptase und Chymase in den Mastzellen. Es führt auch zu einer vermehrten Sekretion proinflammatorischer und matrixabbauender Zytokine wie TNF, IL-1 und IL-17.
Bei hohen Konzentrationen stimuliert IL-33 auch Osteoklasten. Diese fangen dann an, den Knochen zu zerstören. Auf diese Weise greift IL-33 direkt in den entzündlichen Knochenstoffwechsel ein, erklärte Prof. Müller-Ladner. IL-33-Antikörper könnten deshalb in der Therapie rheumatischer Erkrankungen durchaus eine Rolle spielen.
Quelle: 17. Rheumatologie-Update-Seminar