Die drei Phasen der seropositiven rheumatoiden Arthritis
 Am Anfang der Risikophase akkumulieren auto- und polyreaktive B-Zellen und reifen heran.
© Science Photo Library/Gschmeissner, Steve
Am Anfang der Risikophase akkumulieren auto- und polyreaktive B-Zellen und reifen heran.
© Science Photo Library/Gschmeissner, Steve
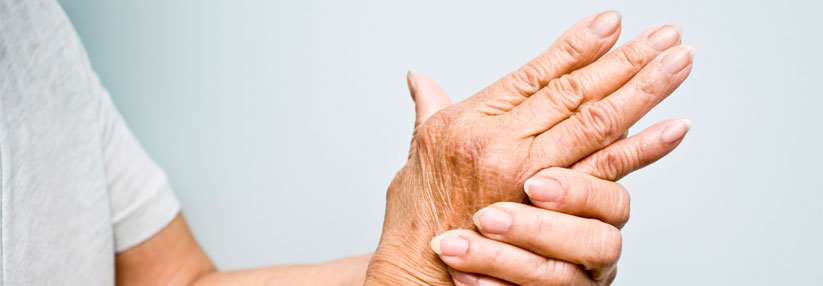
Zwei Drittel aller Patienten mit einer rheumatoiden Arthritis (RA) weisen hohe Antikörpertiter gegen verschiedene Autoantigene auf, sind also seropositiv. Viele Komponenten tragen zur Entwicklung dieser chronisch-entzündlichen Erkrankung bei. Die Rheumatologen Professor Dr. Solbritt Rantapää Dahlqvist, Institution of Public Health and Clinical Medicine/Rheumatology, Umeå University, und Professor Dr. Felipe Andrade, The Johns Hopkins University School of Medicine, Baltimore, geben eine Übersicht zum aktuellen Wissensstand der Ätiologie und erklären die Entwicklung der seropositiven RA in drei Phasen:
1. Risikophase
Viele Jahre, bevor sich eine rheumatoide Arthritis manifestiert, kann ein Zusammenspiel aus genetischen und Umweltfaktoren den Weg der Entstehung ebnen, teilweise bereits im Mutterleib. Diese Faktoren nehmen Einfluss darauf, ob auto- und polyreaktive B-Zellen überleben, reifen und eine Autoimmunantwort vorantreiben. Normalerweise entfernt der Körper solche Zellen.
Genetik
Forscher haben bereits mehr als 100 Genloci mit einer RA in Verbindung gebracht. Am wichtigsten erscheint das Shared Epitope des HLA*-β-Kettengens DRB1 (HLA-SE). Allele für dieses Molekül erhöhen die Wahrscheinlichkeit für eine rheumatoide Arthritis um den Faktor 3. Weiterhin geht das Epitop mit einem schweren Verlauf einher. Wenn die präklinische Phase heranrückt, entwickelt sich eine Assoziation zwischen dem Epitop und den ACPA**.
Umwelt
Ist ein weiblicher Fötus pränatal Zigarettenrauch ausgesetzt, fördert dies die Entwicklung einer juvenilen idiopathischen und einer rheumatoiden Arthritis. Dies gilt jedoch nicht für männlichen Nachwuchs. Weist die Mutter ein HLA-DRB1-Allel auf, das gegen die Erkrankung schützt, kann sie es auf ihr Ungeborenes übertragen.
Weitere Risikofaktoren sind hohes Geburtsgewicht, geringere Stillfrequenz, Infektionen im ersten Lebensjahr sowie Kontakt zu Katzen im Haushalt vor der Pubertät.
2. Präklinische Phase
Sobald die Toleranz gegenüber arthritogenen Autoantigenen schwindet, geht die erste in die zweite Phase über. Sie zeichnet sich durch die Produktion und Reifung von gering pathogenen, zirkulierenden autoreaktiven B-Zellen aus, die akkumulieren. Zusätzlich entwickeln sich inflammatorische Zytokine. Es kommt zur Arthralgie ohne echte Zeichen für eine Arthritis.
Autoimmunreaktion
Verschiedene Autoantikörper wie Rheumafaktoren, ACPA-Isotypen sowie Antikörper gegen carbamylierte oder acetylierte Proteine spielen in der präklinischen Phase eine Rolle. Teilweise findet man sie bereits 15 Jahre vor Symptombeginn im Blut Betroffener. Welche Marker vorliegen, variiert bei jedem Patienten.
Zehn Jahre vor der RA-Manifestation erhöht sich die Konzentration an ACPA. Es besteht die Hypothese, dass primär die Lunge sie produziert. Je näher die klinische Phase kommt, desto höher die Spiegel. Die Autoren vermuten, dass sich das Shared Epitope ausbreitet. Weiterhin werden die Antikörper glykolysiert und reifen somit heran. Auch Antikörper gegen Peptidylarginin-Deiminase (PAD) 2 und 4 schnellen nun in die Höhe.
Zytokine
Sie treiben insbesondere in ACPA-positiven Patienten die Inflammation an. Zusammen mit der Autoantikörperantwort deutet dies auf die dritte Phase hin. Hinsichtlich der Expression der Entzündungsmarker besitzt ebenfalls jeder Patient eine individuelle Variation.
Osteoklasten
„Receptor activator of nuclear factor kappa-B ligand “, kurz RANKL, heißt ein Schlüsselmolekül der Osteoklastenreifung und -aktivierung. Sein Spiegel steigt stetig mit der bevorstehenden Transformation. ACPA-positive Patienten haben besonders hohe Konzentrationen. Bei ihnen findet man teilweise Knochenveränderungen vor den Zeichen einer Gelenkentzündung.
Hormone
Während einige Studien auf einen protektiven Effekt von Östrogen hinweisen, deuten andere wiederum auf eine schädliche Wirkung. Die Experten führen dies auf die pro- und antiinflammatorische Wirkung des Hormons zurück. So unterstützt Östrogen das Überleben von B-Zellen sowie die Antikörperproduktion und könnte damit in der präklinischen Phase die Entwicklung anheizen. Gleichzeitig hemmt es die Produktion von RA-relevanten Zytokinen. Da im Klimakterium der Spiegel des weiblichen Hormons sinkt, schwinden ab diesem Zeitpunkt die Effekte.
Lebensstil
Zigarettenrauch, Staub und Luftverschmutzung steigern das RA-Risiko. Rauchen spielt dabei die größte Rolle. Es steht mit dem Vorliegen von ACPA und Rheumafaktor in Verbindung und fördert vermutlich die autoimmune Reaktion in der Lunge. Noch 20 Jahre nach der letzten Zigarette besteht eine erhöhte Wahrscheinlichkeit für die rheumatische Erkrankung.
Auch schlechte Ernährungsgewohnheiten – viel rotes Fleisch und Salz, geringe Mengen an Vitamin D – befeuern die Entstehung. Zudem begünstigen ein erhöhter BMI und eine umfangreiche Taille die RA. Das in den Adipozyten exprimierte Leptin sorgt u.a. dafür, dass B-Zellen überleben, Makrophagen entzündungsfördernde Zytokine produzieren und die reguläre T-Zell-Funktion verrückt spielt.
Sogar die Zusammensetzung des Mikrobioms und eine frühere Infektion mit dem Epstein-Barr-Virus können den Erkrankungsweg beeinflussen. Schützende Effekte erzielen hingegen eine Ernährung mit Fisch und Omega-3-Fettsäuren, moderater Alkoholkonsum, Statine und die „Pille“.
Parodontitis
Die Pathogenese der rheumatoiden Arthritis und der Parodontitis ähneln sich hinsichtlich Knochenschäden, HLA-SE und den Risikofaktoren Rauchen sowie Nutrition. Die entzündeten Zahntaschen steigern den ACPA-Spiegel und die RA-Gefahr.
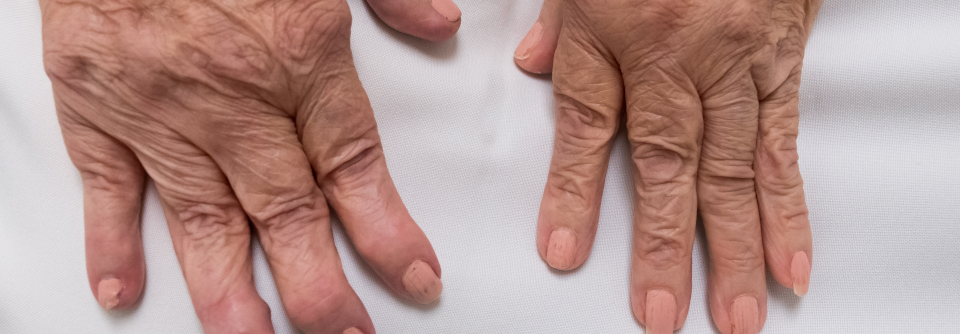
3. Transformationsphase
Bis zu 57 % der Patienten mit einer Arthralgie entwickeln eine rheumatoide Arthritis. Dabei gelten ACPA und Rheumafaktor als stärkste Prädiktoren. Dennoch fehlen Studien, die einen direkten Zusammenhang im Menschen bestätigen. Sobald sich die RA manifestiert hat, ist wieder ein individuelles Zusammenspiel von genetischen und Umweltfaktoren maßgeblich, und zwar diesmal für den Schweregrad und die Progression der Erkrankung. Trotz all der gewonnenen Erkenntnisse: Eine echte Prävention gibt es bislang nicht.
* Human Leukocyte Antigen
** Antikörper gegen citrullinierte Proteine
Quelle: Rantapää Dahlqvist S, Andrade F. J Intern Med 2019; 286: 627-643; DOI: 10.1111/joim.12980