Mukoviszidose: CFTR-Modulatoren bewähren sich auch in fortgeschrittenen Stadien
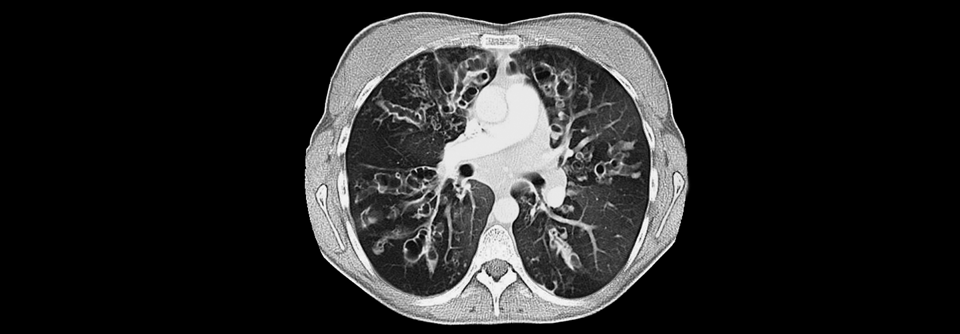
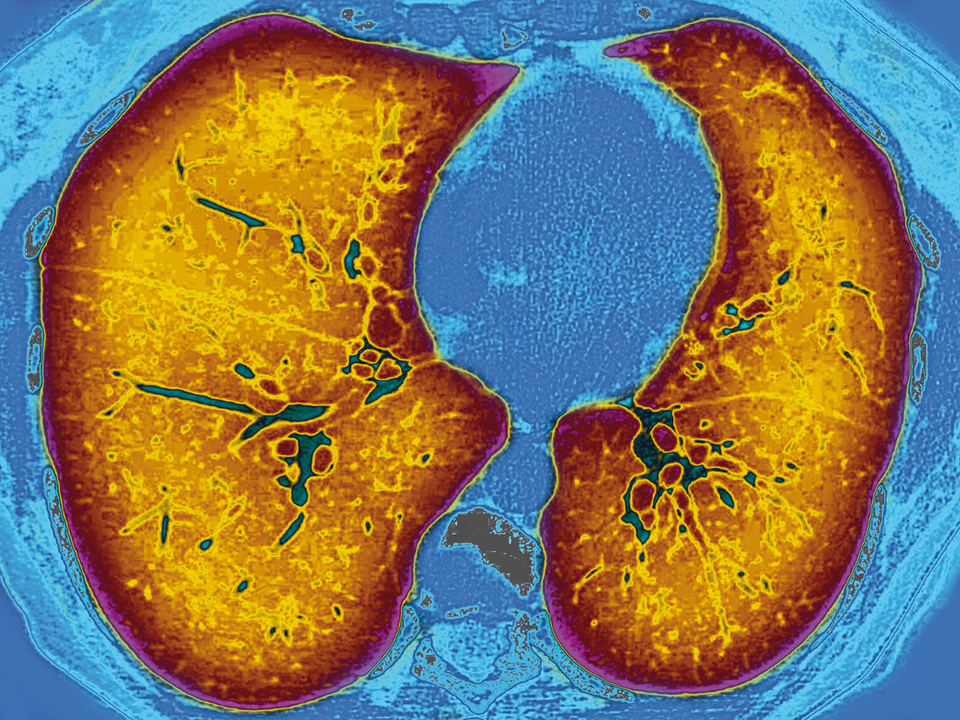
 Computertomographisches BIld einer durch Mukoviszidose veränderten Lunge. Die FEV1 des Patienten ist deutlich eingeschränkt.
© Science Photo Library/Cavallini, James
Computertomographisches BIld einer durch Mukoviszidose veränderten Lunge. Die FEV1 des Patienten ist deutlich eingeschränkt.
© Science Photo Library/Cavallini, James
Die Modulatoren des cystic fibrosis transmembrane regulators (CFTR) agieren auf verschiedene Weise, um dessen Funktion wiederherzustellen. Ivacaftor (IVA) ist ein sog. Potenziator, der den Chloridtransport an der epithelialen Zellmembran verstärkt. Lumacaftor (LUM), Tezacaftor (TEZ) und Elexacaftor (ELX) gehören zu den sog. Korrektoren, welche die Faltung und den Transport des mutierten CFTR-Proteins verbessern.
Die Forschungen zu den verschiedenen Substanzen konzentrierten sich zunächst darauf, bei frühzeitiger Anwendung spätere pulmonale und extrapulmonale Komplikationen der zystischen Fibrose (CF) zu verhindern. Nun handelt es sich aber heute bei der Mehrzahl der Patienten um Erwachsene und viele von ihnen haben bereits Schäden duch den anhaltenden CFTR-Mangel. Sie leiden z.B. unter strukturellen Lungenschäden, chronischen pulmonalen Infektionen oder Malnutrition. Ihr Überleben hängt vor allem vom Ausmaß der pulmonalen Beteiligung ab.
Dr. Michal Shteinberg vom Pulmonary Institute und CF Center, Carmel Medical Center Haifa, und Mitarbeiter untersuchten nun in einem Review die Effekte von CFTR-Modulatoren auf Lungenfunktion, Exazerbationsrate, Ernährungszustand und Lebensqualität bei fortgeschrittener CF.
Therapieerfolge auch bei schwer Erkrankten
Eine Phase-3-Studie zu Ivacaftor hat ziemlich hohe Erwartungen geweckt. Sie zeigte bei Patienten mit G551D-Mutation (gating mutation) eine absolute Zunahme der FEV1 um mindestens 10 % und eine Abnahme der Häufigkeit pulmonaler Exazerbationen um 55 %. Auch das Gewicht und die atmungs-bezogene Lebensqualität stiegen an. Einschlusskriterium für die Studie war ein FEV1-Wert von 40–90 % des Solls gewesen. Es gab auch Teilnehmer, deren FEV1 zwischen Screening und Randomisierung auf weniger als 40 % des Solls abgefallen war. Ableiten ließ sich aus der Studie, dass der Behandlungseffekt bei Teilnehmern mit einer zu erwartenden Lungenfunktion über und unter 70 % ähnlich groß ausfiel.
Nach der Zulassung von IVA haben einige kleinere Studien gezielt CF-Patienten mit fortgeschrittener pulmonaler Beteiligung eingeschlossen, das heißt, solche mit einer FEV1 < 40 % des Solls oder im Wartestand zur Lungentransplantation. In einer dieser Studien, ebenfalls mit Trägern der G551D-Mutation, nahm der FEV1-Wert absolut um 4,2 % signifikant zu. Auch das Körpergewicht stieg signifikant um knapp 2 kg. Und die Zahl von Tagen mit intravenöser Antibiotikatherapie sank von 23 auf 0. Weitere Studien bestätigten solche positiven Effekte auch für Patienten ohne G551D-Mutation.
Die Kombination von IVA und LUM in einer Phase-3-Studie an CF-Kranken mit homozygoter F508del-Mutation beeinflusste die Lungenfunktion schwächer als IVA in anderen Studien. Die FEV1 nahm um 4 % zu. Gleichzeitig halbierten sich jedoch in etwa Hospitalisierungsrate und Häufigkeit intravenöser Antibiotikatherapien. Ein Teil der Patienten dieser Studie hatte initial eine FEV1 < 40 % des Solls. Der Effekt der Behandllung fiel bei ihnen vergleichbar aus wie bei Patienten mit höherem FEV1-Ausgangswert.
Weniger Exazerbationen, z.T. gebesserte Lungenfunktion
Nach der Markteinführung von IVA/LUM ergaben Studien an Patienten mit schwerer Lungenbeteiligung eine Reduktion von Exazerbationen, einige auch eine Besserung von Lungenfunktion, Ernährungszustand und Lebensqualität – nicht immer waren die Unterschiede signifikant.
Im Prinzip ähnliche Ergebnisse brachte die Kombination IVA/TEZ bei F508del-Mutation. Das Hinzufügen eines weiteren Korrektors, ELX, bescherte dieser Therapie einen erheblichen Gewinn an Wirksamkeit. Patienten mit einem initialen FEV1-Wert < 40 % des Solls legten im Mittel um 15 % zu.
IVA/TEZ als sichere Basis für die Triple-Kombi mit ELX
IVA erwies sich insgesamt als sehr gut verträglich. Unter der IVA/LUM-Kombination trat relativ häufig eine Dyspnoe auf. Von den Teilnehmern mit stark eingeschränkter Lungenfunktion gab ein Viertel diese Nebenwirkung an. Assoziiert war diese offenbar mit einem akuten vorübergehenden Abfall der Lungenfunktion. Kein derartiger Effekt wurde bei IVA/TEZ gesehen.
Auch Medikamenteninteraktionen bereiteten vor allem bei LUM Probleme. IVA/TEZ scheint damit eine sicherere Basis für die Tripelkombination mit ELX bei F508del-Mutation zu sein. Das ist vor allem für Patienten mit schwerer pulmonaler Beteiligung sehr wichtig. Die Datenlage spricht für den Einsatz der teuren innovativen Substanzen auch in dieser Patientengruppe. Die amerikanische Arzneimittelbehörde FDA hat die hocheffektive Tripletherapie für CF-Patienten breit zugelassen.
Quelle: Shteinberg M et al. Eur Respir Rev 2020; 29: 190112; DOI: 10.1183/16000617.0112-2019
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).