RRMS: Welche ist die richtige Therapiesequenz?
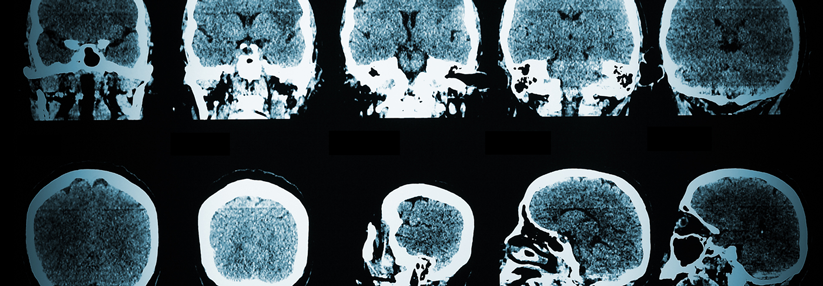 Die Zahl der MRT-Läsionen gilt als ein prognostisch relevanter Progressionsmarker bei der RRMS.
© iStock/sudok1
Die Zahl der MRT-Läsionen gilt als ein prognostisch relevanter Progressionsmarker bei der RRMS.
© iStock/sudok1
Mit der inzwischen großen Auswahl an Therapeutika zur Behandlung der schubförmig-remittierenden Multiplen Sklerose (RRMS) zeigte sich Professor Dr. Sven G. Meuth von der neurologischen Universitätsklinik Münster durchaus zufrieden. Allerdings würden die Zulassungsstudien keine Aussage darüber zulassen, welche Reihenfolge der Substanzen für welchen Patienten die beste sei.
Um diese praxisrelevante Frage zu beantworten, müssten andere Daten herangezogen werden, solche aus Real-Life-Beobachtungsstudien und aus Registern. Nur dumm, dass viele Daten, die betreuende Ärzte tagein, tagaus sorgfältig dokumentieren, bislang nicht für Register genutzt werden, bedauerte der Kollege.
Für einen langfristig günstigen RRMS-Verlauf sorgen
In verschiedenen Bobachtungsstudien hat sich als prognostisch relevanter Marker für die Zunahme der Behinderung die Zahl der Läsionen in der Magnetresonanztomographie (MRT) herausgestellt.1,2 Der Vergleich rezenter mit früheren Kohorten belegt, dass die neueren Therapien wirksam sind und den RRMS-Verlauf deutlich verlangsamt haben. Laut der MS-Base-Studie wirkt sich insbesondere der frühe Einsatz hochwirksamer Therapeutika günstig auf den langfristigen Krankheitsverlauf aus, berichtete Prof. Meuth.3 Doch was, wenn diese nicht ausreichen oder aus anderen Gründen abgesetzt werden müssen?
Das derzeit am häufigsten verordnete Medikament bei aktiver RRMS ist Fingolimod, erklärte der Experte. Unter der Substanz könne es – wenn auch selten und unabhängig von einer Vorbehandlung mit Natalizumab – zu einer progressiven multifokalen Leukenzephalopathie (PML) kommen. Eine Risikostratifizierung wie für Natalizumab gebe es für Fingolimod aber nicht. Patienten im Alter von über 50 Jahren hätten ein erhöhtes PML-Risiko.
Von Fingolimod auf ein anderes Medikament umzustellen, kann wegen erneuter Krankheitsaktivität notwendig werden oder auch bei Kinderwunsch. Ein Rote-Hand-Brief stellte in diesem Jahr klar, dass Schwangerschaft oder eine nicht ausreichende Verhütung als Kontraindikation für die Therapie mit Fingolimod gelten.4 Soll auf Alemtuzumab geswitcht werden, sollte zunächst die Erholung der Lymphozytenzahl auf Werte von 800 bis 1000 Zellen/ml abgewartet werden, riet Prof. Meuth. Denn wird Alemtuzumab zu früh gegeben, „erwischt“ es die noch durch Fingolimod im Lymphknoten festgehaltenen und erst später freigesetzten autoreaktiven Lymphozyten nicht. Dann droht eine zum Teil massive Krankheitsaktivität.5
Die Wirksamkeit von Natalizumab ist hoch, allerdings steigt das PML-Risiko bei einer Therapie von mehr als zwei Jahren auch bei Patienten, die zu Beginn JC-Virus-negativ sind, deutlich an. Prof. Meuth bezifferte die Serokonversionsrate auf etwa 10 % pro Jahr, weshalb die JC-Virus-Antikörper-Titer unter Natalizumab-Therapie halbjährlich überprüft werden sollten. In einer Beobachtungsstudie war das PML-Risiko bei verlängerten Infusionsintervallen erniedrigt. Ob dies bei einer Wirkstoffgabe alle sechs Wochen tatsächlich so ist und die Patienten ihre Therapie möglicherweise länger bei akzeptablem Risiko erhalten können, wird derzeit in einer Studie untersucht.
Von Natalizumab auf Fingolimod oder Rituximab?
Muss von Natalizumab auf ein anderes MS-Medikament umgestellt werden, bieten sich nach Aussage von Prof. Meuth zwei Alternativen an, für die Daten aus einer Beobachtungsstudie vorliegen. Unter Fingolimod blieben 80 % der Patienten mit RRMS und JC-Virus-Serokonversion stabil, noch mehr (95%) waren es unter Rituximab.6
Alemtuzumab führt mit nur zwei Behandlungsphasen zu einer signifikanten Depletion von B- und T-Zellen und bei einem Teil der Patienten zu einer langen Freiheit von Krankheitsaktivität. Welche Therapie bei wiederaufflammender MS die günstigste ist, weiß man noch nicht. Gleiches gilt für die noch nicht so lange zugelassenen, sehr wirksamen Therapieoptionen Ocrelizumab und Cladribin, betonte Prof. Meuth.
Normalisierung des Blutbilds möglichst immer abwarten
Beim Switch von einer auf eine andere RRMS-Therapie sind unterschiedliche Zeiten zu berücksichtigen. (Nur nach Interferonen, Glatirameracetat und Dimethylfumarat darf ohne Pause umgestellt werden.) Die Dauer der Auswaschphase ist vom Wirkmechanismus der Vortherapie abhängig, die Normalisierung des Blutbilds sollte laut Prof. Meuth möglichst immer abgewartet werden. Bei Fingolimod dauert die Auswaschphase vier Wochen, wird Teriflunomid beschleunigt ausgewaschen, muss ebenfalls mit vier Wochen Therapiepause gerechnet werden.
Sechs bis acht Wochen sollte man nach der letzten Natalizumab-Gabe warten, erst dann kann man mit der nächsten Therapie starten. Nach Azathioprin, Methotrexat, Ciclosporin A, Mycophenolat mofetil, Mitoxanthron und Cyclophosphamid sind es drei Monate, nach Alemtuzumab, Rituximab, Ocrelizumab und Cladribin sechs bis zwölf Monate.
Quellen:
1 Brex PS et al. N Engl J Med 2002; 346: 158–164; DOI: 10.1056/NEJMoa011341
2 Tintoré, M. ECTRIMS 2018; Abstract 154
3 Brown JWL et al. ECTRIMS 2017, Abstract 128
4 Rote-Hand-Brief zu Fingolimod vom BfArM
5 Willis M et al. Neurol Neuroimmunol Neuroinflamm 2017; 4: e320; DOI: /10.1212/NXI.0000000000000320
6 Alping P et al. Ann Neurol 2016; 79: 950-8; DOI: 10.1002/ana.24651
Kongressbericht: 92. Kongress der Deutschen Gesellschaft für Neurologie
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).