Neue Option beim kutanen T-Zell-Lymphom: Anti-CCR4-Antikörper schlägt Zweitlinienstandard Vorinostat
 Beim kutanen T-Zell-Lymphom (CTCL) hat ein neues Wirkprinzip eine hohe Aktivität gezeigt.
© iStock/luismmolina
Beim kutanen T-Zell-Lymphom (CTCL) hat ein neues Wirkprinzip eine hohe Aktivität gezeigt.
© iStock/luismmolina
Nach vielversprechenden Ergebnissen zu Mogamulizumab in einer Phase-I/II-Studie beim CTCL wurde der Antikörper in der Phase-III-Studie MAVORIC im randomisierten Design mit dem bisherigen Zweitlinienstandard Vorinostat verglichen.1 „MAVORIC ist die größte randomisierte Studie beim CTCL, in der eine neue systemische Therapie mit einem zugelassenen Medikament verglichen wird und gleichzeitig die erste zulassungsrelevante Studie mit dem primären Endpunkt progressionsfreies Überleben“, informierte Professor Dr. Youn H. Kim von der Universität Stanford.
Verdoppeltes PFS in allen Subgruppen
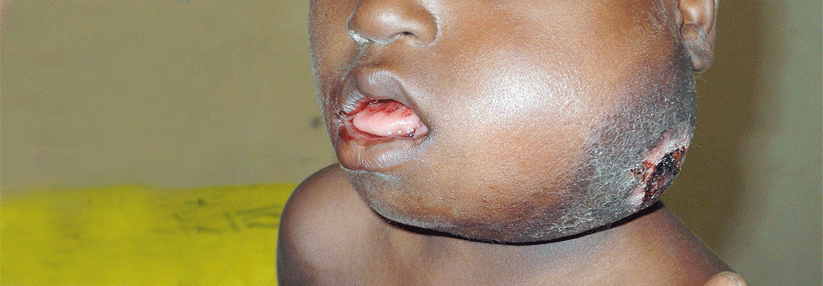
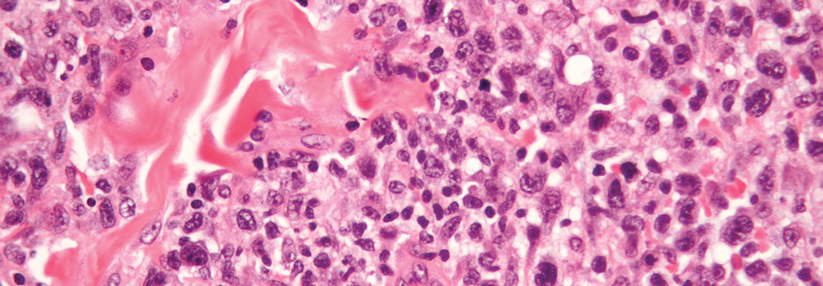
Die Studie umfasste 372 vorbehandelte Patienten mit histologisch gesichertem Mycosis fungoides (MF) oder…
Bitte geben Sie Ihren Benutzernamen und Ihr Passwort ein, um sich an der Website anzumelden.