Schritt für Schritt knacken
 Will die RA-Therapie nicht greifen, muss ein anderer Fahrplan her.
© SerdarKutlu – stock.adobe.com
Will die RA-Therapie nicht greifen, muss ein anderer Fahrplan her.
© SerdarKutlu – stock.adobe.com
Jeder Rheumatologe kennt sie: RA-Patienten, die auf keine therapeutische Strategie ansprechen. Eine 34-köpfige EULAR-Taskforce um Prof. Dr. Györgi Nagy, Abteilung für Rheumatologie der Semmelweis-Universität in Budapest, hat sich daher der Frage angenommen, wie man eine solche „Difficult-to-treat“(D2T)-RA am besten managt.1 Sie berücksichtigten neben den Ergebnissen einer umfangreichen Literaturrecherche auch die Erfahrungen von Pharmakologen, Psychologen, Fachpflegekräften und Patienten. Erarbeitet wurden außer einer exakten Definition der D2T-RA (s. Kasten) zwei übergreifende Grundsätze und eine Roadmap, die bei Verdacht auf D2T-RA systematisch abzuarbeiten ist.
Kennzeichen einer D2T-RA
Die Diagnose D2T-RA gilt als gesichert, wenn folgende Kriterien erfüllt sind:
- Versagen von mindestens zwei b/tsDMARD mit unterschiedlichen Wirkmechanismen (gemäß EULAR-Empfehlungen) nach ebenfalls erfolgloser csDMARD-Therapie (außer, wenn diese kontraindiziert war)
- Anzeichen für eine aktive bzw. progressive Erkrankung, definiert durch einen oder mehrere der folgenden Aspekte:
- mindestens moderate Krankheitsaktivität, festgestellt anhand von validierten Scores (z.B. DAS28-ESR > 3,2 oder CDAI > 10)
- Zeichen einer aktiven Erkrankung (z.B. Akute-Phase-Reaktionen, Bildgebung) und/oder typische Symptome (gelenkbezogen oder andere)
- Reduktion von Prednison oder Äquivalent auf < 7,5 mg/d nicht möglich
- rasche radiologische Verschlechterung (z.B. Veränderung im Sharp-Score ≥ 5 Punkte/Jahr) mit/ohne Anzeichen für hohe Krankheitsaktivität
- trotz gut kontrollierter Erkrankung Fortbestehen von RA-Symptomen, die die Lebensqualität mindern
- Management der Erkrankung aus Sicht des Rheumatologen und/oder Patienten problematisch
Der erste Grundsatz besagt, dass alle bisherigen EULAR-Empfehlungen auch für die D2T-RA gelten. Zusätzlich dazu soll der neu entwickelte 11-Punkte-Fahrplan dem behandelnden Arzt das Management der Erkrankung erleichtern. Die zweite Regel ist, dass die Entscheidung für eine pharmakologische und/oder nicht-pharmakologische Therapie vom Entzündungsstatus abhängt. Der 11-Punkte-Plan umfasst folgende Schritte:
1. Bei Verdacht auf eine therapieresistente RA sind im ersten Schritt Fehldiagnosen und/oder imitierende Begleiterkrankungen sicher auszuschließen. Fehldiagnosen drohen vor allem bei Vorliegen einer seronegativen RA. Auch das Ziel, so frühzeitig wie möglich therapeutisch eingreifen zu wollen, kann zu einer vorschnellen und u.U. falschen Diagnose führen. Erkrankungen, die eine RA vortäuschen können, sind beispielsweise Kristallarthropathien, Polymyalgia rheumatica, Psoriasisarthritis oder Spondyloarthritis.
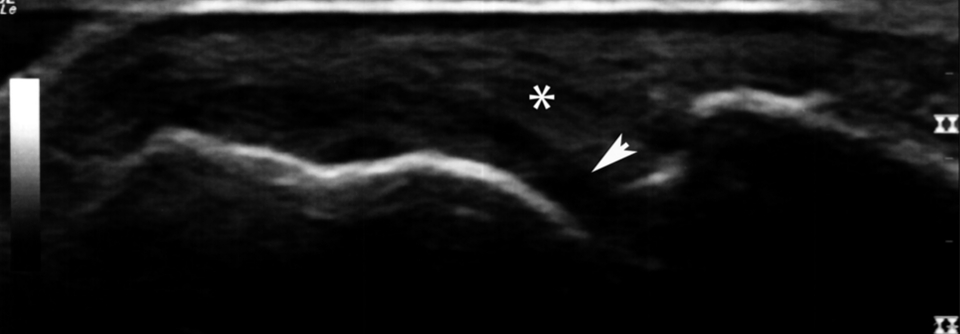
2. Lässt sich anhand von Klinik und Scores nicht klären, ob eine Entzündung vorliegt, empfiehlt sich ein Gelenkultraschall. Besonders hilfreich ist der Ultraschall z.B. bei Adipösen oder Patienten, die gleichzeitig an einer Fibromyalgie leiden. Als weniger überzeugend für den Nachweis einer Entzündung schätzten die Experten dagegen andere bildgebende Verfahren wie die MRT oder Biomarker (z.B. Fibrinogen, Resistin, Interleukin-6) ein.
3. Bestehen Komorbiditäten, ist die Bewertung der Krankheitsaktivität auf Basis von Scores und klinischer Untersuchung mit Vorsicht zu genießen. Vor allem Adipositas und Fibromyalgie führen dazu, dass die entzündliche Aktivität entweder erhöht ist oder überschätzt wird.
4. Bei Verdacht auf eine therapieresistente RA ist immer die Therapieadhärenz zu prüfen und zu verbessern. Non-Compliance kommt bei 30–80 % aller RA-Patienten vor und ist besonders bei D2T-RA stark verbreitet. Das Assessment von Non-Compliance und der Umgang damit sind zentrale Themen eines weiteren EULAR-Projekts.2
5. Nach Versagen eines zusätzlichen oder nachfolgenden zweiten b/tsDMARD sowie nach zwei erfolglosen Versuchen mit TNF-alpha-Hemmern ist der Einsatz eines b/tsDMARD mit anderem Wirkmechanismus zu erwägen. In einigen Studien waren Tocilizumab, Tofacitinib, Baricitinib, Upadacitinib oder Filgotinib als drittes oder viertes b/tsDMARD effektiver als Placebo. Eine Präferenz für einen der Wirkstoffe leitet die Taskforce daraus allerdings nicht ab.
6. Falls ein drittes b/tsDMARD zusätzlich oder nachfolgend sinnvoll erscheint, sollte die höchstmögliche Dosis eingesetzt werden. Dabei ist zu berücksichtigen, dass dessen Wirkung in Studien geringer war, wenn vorher mehrere DMARD versagt hatten. Tendenziell war dieser negative Effekt weniger ausgeprägt bei Tocilizumab i.v. (8 mg/kg), Baricitinib (4 mg/d; Achtung: kein Einsatz bei Patienten > 75 Jahre oder Kreatinin-Clearance von 30–60 ml/min) und Tofacitinib (2x10 mg/d; Achtung: aufgrund von Nebenwirkungen nur 2x5 mg/d zugelassen).
7. Komorbiditäten, die die Lebensqualität beeinflussen, sind bestmöglich zu behandeln und bei der Wahl der antirheumatischen Wirkstoffe zu berücksichtigen. Dies gilt den Autoren zufolge z.B. für Adipositas. So ist i.v.-Infliximab bei einem BMI > 30 kg/m2 weniger effektiv als bei einem BMI darunter. Bei Patienten mit einem Risiko für Venenthrombosen sind tsDMARD mit besonderer Vorsicht anzuwenden. Auch bei rezidivierendem Herpes zoster (keine Januskinase-Inhibitoren!) oder Divertikulitis (kein Tocilizumab!) ist umsichtiges Handeln gefragt.
8. Patienten mit HBV- und/oder HCV-Infektionen können mit b/tsDMARD behandelt werden. Die begleitende antivirale Prophylaxe oder Therapie sollte jedoch in enger Zusammenarbeit mit dem Hepatologen erfolgen.
9. Schmerzen, Fatigue und Funktionseinschränkungen sind zusätzlich zur medikamentösen Therapie auch nicht-pharmakologisch zu behandeln. Dies gilt unabhängig davon, ob aktuell eine Entzündung vorliegt oder nicht. Bewegungstherapien wie Aerobic, Wassergymnastik, Krafttraining und spezielle Übungen für die Hände scheinen wirkungsvoll zu sein. Kognitive Verhaltenstherapien und Stressmanagement helfen nachgewiesenermaßen bei Schmerzen und Fatigue.
10. Patienten sind bestmöglich über ihre Erkrankung und die Therapieoptionen aufzuklären. Als hilfreich haben sich dabei auch webbasierte Programme erwiesen. Therapieziele von D2T-Patienten müssen zudem immer maßgeschneidert werden, um Frustrationen vorzubeugen und die Adhärenz zu erhalten.
11. Um den Umgang mit der chronischen Erkrankung zu verbessern, sollten den Patienten spezielle Programme und psychologische Interventionen angeboten werden. Ziel ist es, den Glauben der Patienten an sich selbst und die Überzeugung zu stärken, dass sie schwierige Situationen selbst meistern können (Selbstwirksamkeit). Mithilfe der Arthritis Self-Efficacy Scale kann man diese Selbstwirksamkeit messen. Ist sie gering ausgeprägt, lässt sie sich oft durch Einzel- bzw. Gruppentherapien oder unterstützende mobile Apps stärken.
Quellen:
1. Nagy G et al. Ann Rheum Dis 2021; DOI: 10.1136/annrheumdis-2021-220973
2. Ritschl V et al. Ann Rheum Dis 2020; DOI: 10.1136/annrheumdis-2020-218986
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).


