Wann beim Barrett-Ösophagus eine Radiofrequenzablation nötig ist
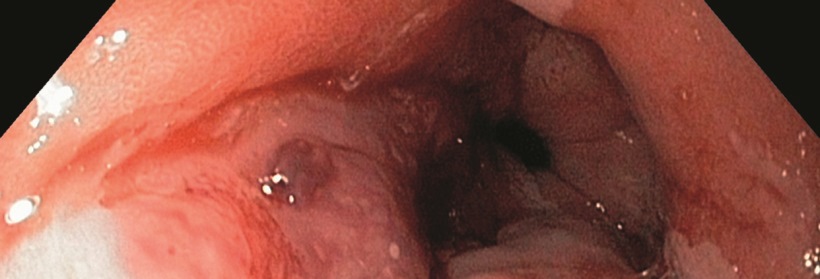
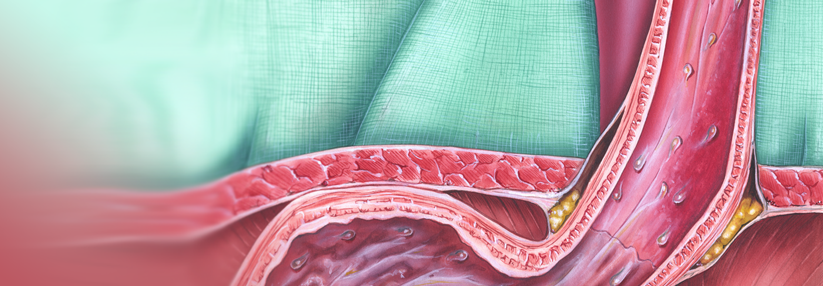
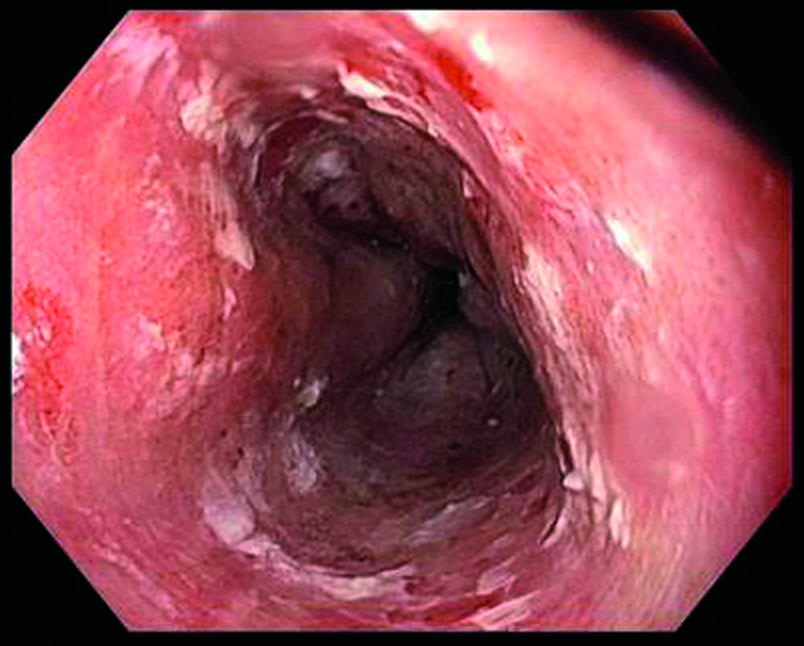
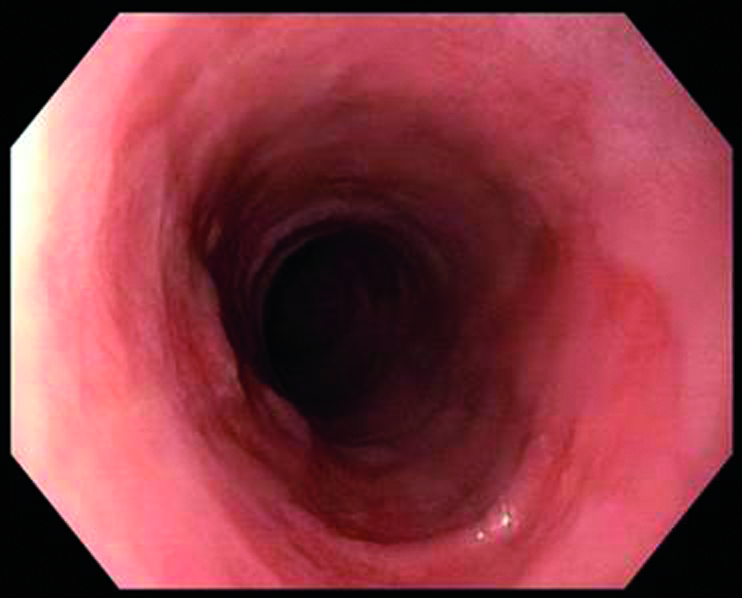
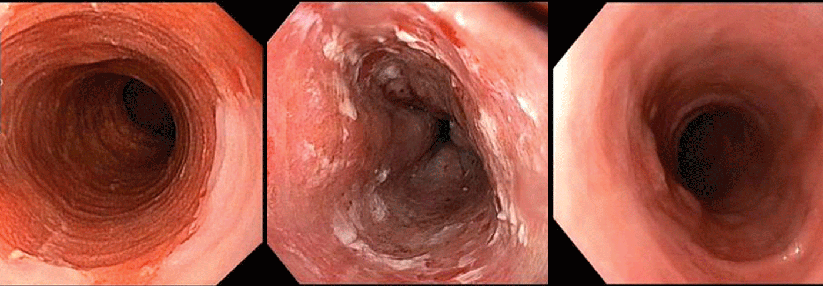 Ablation eines zirkulären Barrett-Ösophagus (Prag-Klassifikation C11, M1): vor Ablation (links) unmittelbar nach der zirkulären Radiofrequenzablation (Mitte) und drei Monate nach Ablation mit stattgehabter Reepithelialisierung (rechts).
© Striegel J, Jakobs R. internistische praxis 2018; 59: 43-51 © Mediengruppe Oberfranken – Fachverlage GmbH & Co. KG, Kulmbach
Ablation eines zirkulären Barrett-Ösophagus (Prag-Klassifikation C11, M1): vor Ablation (links) unmittelbar nach der zirkulären Radiofrequenzablation (Mitte) und drei Monate nach Ablation mit stattgehabter Reepithelialisierung (rechts).
© Striegel J, Jakobs R. internistische praxis 2018; 59: 43-51 © Mediengruppe Oberfranken – Fachverlage GmbH & Co. KG, Kulmbach
Es sind wahrlich kleine Details, die beim Barrett-Ösophagus den Unterschied ausmachen: 0,12–0,3 % beträgt das jährliche Progressionsrisiko zum Adenokarzinom, wenn das metaplastische Zylinderepithel das ursprüngliche Plattenepithel in der Speiseröhre ersetzt hat. Sind jedoch erste Neoplasien im Epithel entstanden, geht es schneller: Eine niedriggradige Dysplasie wandelt sich in zwölf Monaten in 13,4 % der Fälle in eine hochgradige um.
Die diagnostische Strategie zielt deshalb darauf ab, solche Schleimhautveränderungen rechtzeitig zu entdecken und neoplastische von harmloseren Stadien zu unterscheiden, schreiben Dr. Johannes Striegel und Professor Dr. Ralf Jakobs von der Medizinischen Klinik C des Klinikums Ludwigshafen am Rhein. Die Leitlinie der deutschen Gesellschaft für Verdauungs- und Stoffwechselerkrankungen (DGVS) rät, bei endoskopischem Verdacht alle suspekten Areale im betroffenen Abschnitt zu biopsieren und über das Barrett-Segment alle ein bis zwei Zentimeter eine 4-Quadranten-Probeentnahme durchzuführen.
Keine Krebsprophylaxe mit Medikamenten
Sinnvolles Kontrollintervall: alle drei bis fünf Jahre
Über das weitere Vorgehen gibt es jedoch zwischen europäischen und deutschen Experten Uneinigkeiten. Während die DGVS in der aktuellen Leitlinie bei fehlenden Neoplasien empfiehlt, nach zwölf Monaten endoskopisch nachzukontrollieren, befürwortet die europäische Gesellschaft für gastrointestinale Endoskopie ein weniger invasives Vorgehen:- Barrett-Segmente < 1 cm Länge: Routinekontrollen überflüssig (Hier seien keine Adenokarzinome zu befürchten)
- ≥ 1 bis < 3 cm: Endoskopie nach fünf Jahren
- ≥ 3 cm bis < 10 cm: Kontrolle nach nach drei Jahren
- ≥ 10 cm: Überweisung an Spezialzentrum
Auch hochgradigen Neoplasien mit Strom den Garaus machen
Die Ablation (s. Kasten) ist auch bei sichtbaren hochgradigen Veränderungen Therapie der Wahl. Manifeste Adenokarzinome werden endosonographisch weiter diagnostiziert und dann für die eingehendere Tumordiagnostik endoskopisch reseziert. OP-Indikationen umfassen eine Lymph- bzw. Blutgefäßinvasion, eine tiefe Infiltration in die Submukosa, einen schlechten Differezierungsgrad sowie einen Tumorrest am basalen Resektionsrand.Verbrutzelt und abgekratzt
Manche dysplastische Zelle wird lediglich vergraben
Sämtliche ablative Verfahren gehen mit einem Langzeitproblem einher: den sogenannten „buried glands“. Das sind nicht erfasste dysplastische Zellen, die sich nach der Reepithelisierung wieder ausbreiten können und durch oberflächliche Kontrollbiopsien nicht erfasst werden. Die klinische Bedeutung solcher Zellen bleibt laut den Experten derzeit aber unklar. Grundsätzlich profitieren Patienten mit Neoplasien in der Barrett-Schleimhaut von einem Überwachungsprogramm.Quelle Text und Abb.: Striegel J, Jakobs R. internistische praxis 2018; 59: 43-51 © Mediengruppe Oberfranken – Fachverlage GmbH & Co. KG, Kulmbach
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).
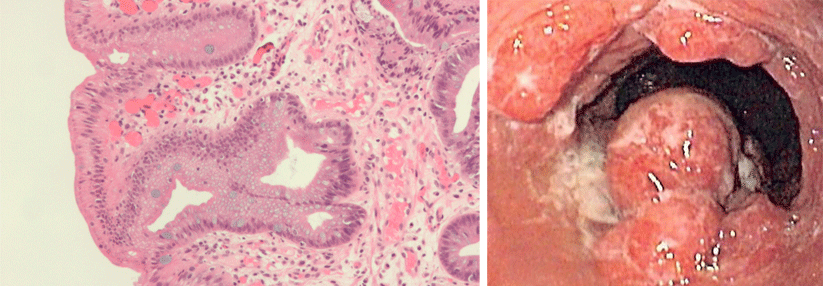
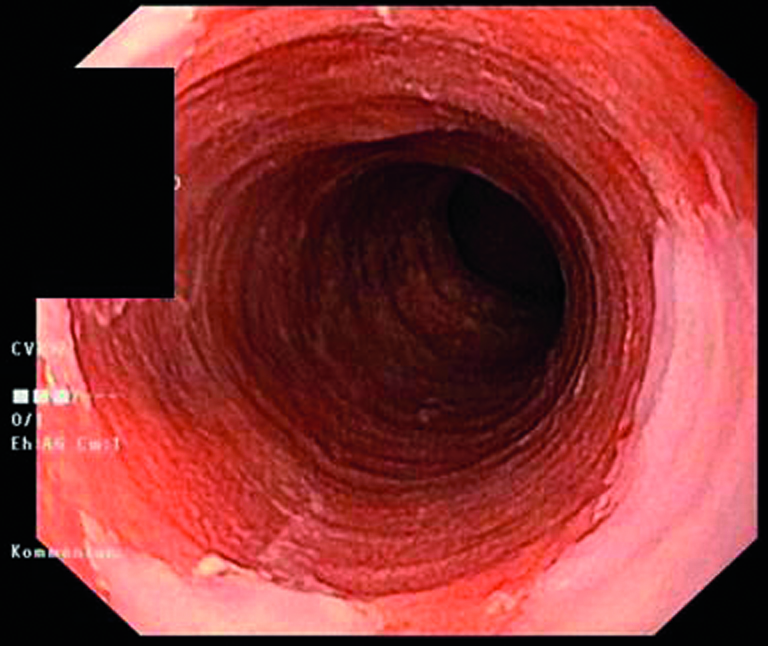
 Ablation eines zirkulären Barrett-Ösophagus (Prag-Klassifikation C11, M1): vor Ablation (links) unmittelbar nach der zirkulären Radiofrequenzablation (Mitte) und drei Monate nach Ablation mit stattgehabter Reepithelialisierung (rechts).
© Striegel J, Jakobs R. internistische praxis 2018; 59: 43-51 © Mediengruppe Oberfranken – Fachverlage GmbH & Co. KG, Kulmbach
Ablation eines zirkulären Barrett-Ösophagus (Prag-Klassifikation C11, M1): vor Ablation (links) unmittelbar nach der zirkulären Radiofrequenzablation (Mitte) und drei Monate nach Ablation mit stattgehabter Reepithelialisierung (rechts).
© Striegel J, Jakobs R. internistische praxis 2018; 59: 43-51 © Mediengruppe Oberfranken – Fachverlage GmbH & Co. KG, Kulmbach