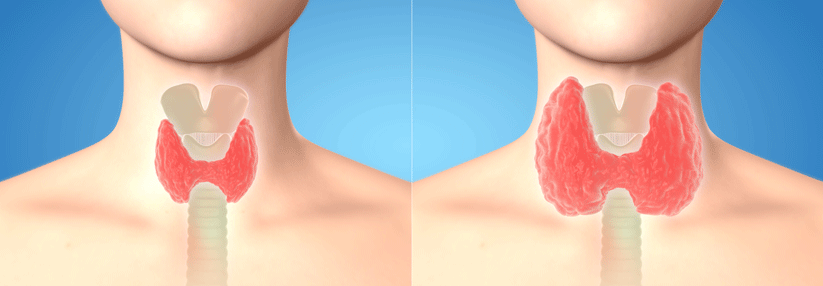
Gestörte Schilddrüsenfunktion sorgt für kardiale Probleme
 Jetzt hat‘s das Herz am Hals.
© iStock/Shidlovski
Jetzt hat‘s das Herz am Hals.
© iStock/Shidlovski
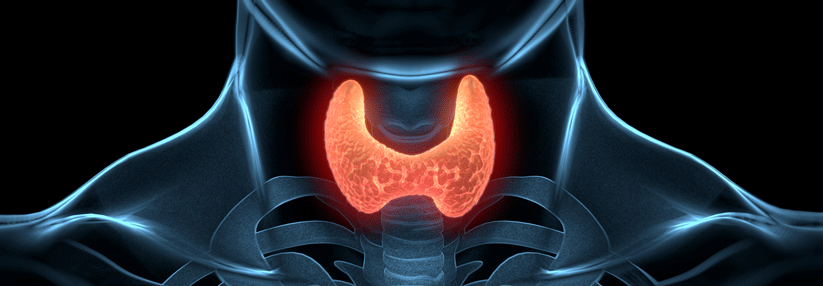
Je nachdem, ob nur der TSH-Wert den Normbereich verlassen hat oder auch die peripheren Schilddrüsenhormonwerte, unterscheidet man die subklinische von der manifesten Funktionsstörung. Abweichende TSH-Werte sind keine Seltenheit: Jeder zehnte Mensch bietet im Labor eine subklinische Hypothyreose, bis zu 12 % haben isoliert verminderte TSH-Werte.
Bei der subklinischen Hyperthyreose muss man differenzialdiagnostisch nicht nur an Klassiker wie den M. Basedow denken. Zu den selteneren möglichen Ursachen gehören die Hypophyseninsuffizienz, Medikamente oder psychiatrische Erkrankungen, schreiben Dr. Ulrich Dischinger und Professor Dr. Martin Fassnacht von der Medizinischen Klinik I am Universitätsklinikum Würzburg. Die Wahrscheinlichkeit für eine spätere manifeste Überfunktion lässt sich aus der Höhe des TSH-Werts ableiten. Mit Spiegeln zwischen 0,1 und 0,29 mIU/ml liegt die Wahrscheinlichkeit über einen Zeitraum von sieben Jahren unter 1 %. Mit Werten < 0,1 mIU/ml klettert sie auf 20 %.
Hormonspiegel nach vier bis acht Wochen erneut messen
Für alle subklinischen Störungen gilt: Die einmalige Laborkonstellation genügt nicht für eine Diagnose, stattdessen müssen die Schilddrüsenparameter nach vier bis acht Wochen erneut bestimmt werden. Bestätigt sich eine subklinische Hyperthyreose (TSH < 0,1 ml/l), sollte man zuerst exogene und nicht primär thyreoidale Ursachen (z.B. T4-Überdosierung) ausschließen, ehe Sonographie, TSH-Rezeptor-Antikörpermessung und eventuell die Szintigraphie zum Einsatz kommen. Diese Untersuchungen werden bei der manifesten Überfunktion bereits initial eingesetzt. Bei der subklinischen Hypothyreose erfolgen Ultraschall und Thyreoperoxidase (TPO)-Antikörper-Test, die Szintigraphie spielt hier keine Rolle.
Die meisten Studien über den Zusammenhang zwischen pathologischen Schilddrüsenbefunden und dem Herzen haben nur Beobachtungscharakter. Sie können also keine Kausalität belegen, räumen die Autoren ein. Dennoch lässt sich festhalten, dass diese Veränderungen Einfluss auf das kardiovaskuläre System nehmen. So steigt das Mortalitätsrisiko mit zunehmendem fT4 erheblich an. 10–25 % der Patienten mit manifester Hyperthyreose haben ein – oft permanentes – Vorhofflimmern, das schlecht auf Konversionsversuche anspricht. Allerdings gelingt es bei 55–75 % der Betroffenen, durch eine Normalisierung des Stoffwechsels die dauerhafte Rückkehr in den Sinusrhythmus zu erzielen – vorausgesetzt, die Rhythmusstörung hat keine anderen Ursachen.
Kausale Assoziation mit pulmonaler Hypertonie?
Die Effekte von T4 bzw. T3 (siehe Kasten) bergen auch die Gefahr, eine Herzinsuffizienz zu induzieren oder zu verschlimmern. Im Gegensatz zur klassischen Kardiomyopathie ist bei der Hyperthyreose der Auswurf vermehrt und der systolische Blutdruck erhöht. Außerdem besteht eine größere atriale Arrhythmiegefahr. Für die manifeste Hypothyreose und schwerere subklinische Störungen (TSH mindestens 10 mIU/l oder < 0,10 mIU/l) ließ sich ein vermehrtes Risiko für ein akutes Herzversagen zeigen.
Was Triiodthyronin im Körper macht
Schutzmaßnahme funktioniert nicht
Quelle: Dischinger U, Fassnacht M. Internist 2018; 59: 668-673
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).