Arteriovenöse Shunts des Morbus Osler: Gefahr für Lunge, Leber und Gehirn
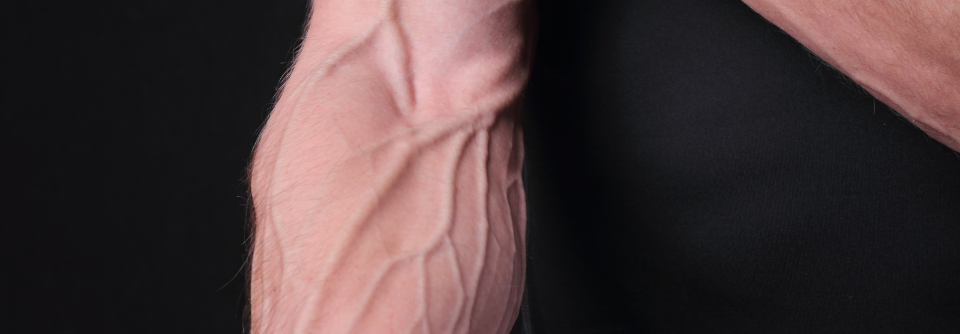
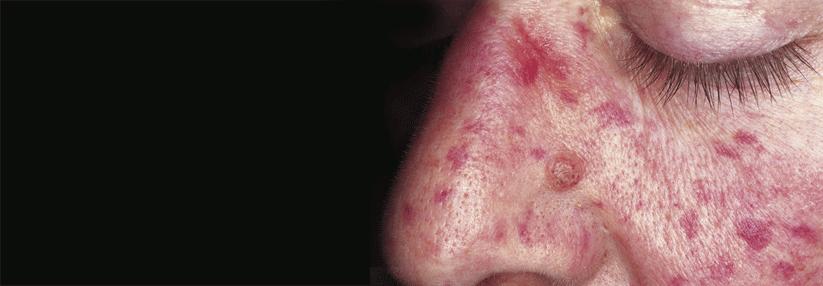 Die klassischen Teleangiektasien des M. Osler finden sich bevorzugt im Gesicht.
© wikimedia/ M. Sand, D. Sand, C. Thrandorf, V. Paech, P. Altmeyer, F. G. Bechara
Die klassischen Teleangiektasien des M. Osler finden sich bevorzugt im Gesicht.
© wikimedia/ M. Sand, D. Sand, C. Thrandorf, V. Paech, P. Altmeyer, F. G. Bechara
Mit einer Prävalenz von 1:5000 gehört der M. Osler, auch hereditäre hämorrhagische Teleangiektasie (HHT) genannt, zu den seltenen Erkrankungen. Die Patienten leiden vor allem unter spontanem rezidivierendem Nasenbluten. Die typischen Teleangiektasien finden sich bevorzugt an Lippen, Nase, aber auch an Fingern oder Zunge, schreiben Privatdozent Dr. Frank Haubner von der HNO-Klinik am Klinikum der Universität München, Campus Großhadern, und Kollege.
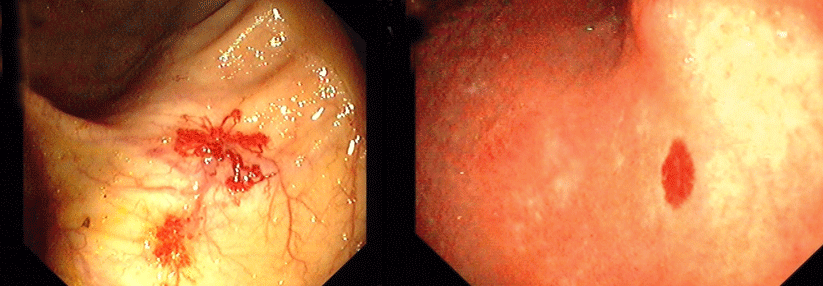
Die kleinen arteriovenösen (AV-)Malformationen treten bei HHT aber nicht nur auf der Haut auf, sondern ebenso in inneren Organen, wo sie beachtliche Ausmaße annehmen können. An der Nasenschleimhaut lassen sich die Herde, Osler-Pits genannt, gut erkennen, da sie hier besonders oberflächlich liegen. Ab einer gewissen Größe steigt das Risiko für relevante Blutungen.
Ist der Patient anämisch?
Endothelzellen spielen besondere Rolle
Der Erbkrankheit liegen verschiedene Genmutationen zugrunde, die im Signalweg für den „transforming growth factor b“ angesiedelt sind und die für wichtige Proteine der Zellproliferation, Differenzierung und Apoptose kodieren. Die meisten Krankheitsfälle (ca. 80 %) gehen auf Mutationen der Gene ENG und ACVRL1 zurück, die für die Expression von Endoglin und ALK1 verantwortlich sind. Endoglin und ALK1 werden überwiegend auf Endothelzellen exprimiert, sodass diese in der Pathogenese der HHT eine besondere Rolle spielen. Ein M. Osler kann diagnostiziert werden, wenn drei der vier Curaçao-Kriterien vorliegen (s. Tabelle). Zusätzlich kann man eine humangenetische Beratung und Gendiagnostik anbieten. Bei der Betreuung von HHT-Patienten gilt es dann, an die Möglichkeit viszeraler Manifestationen zu denken, die lange Zeit klinisch stumm bleiben.| Die Curaçao-Kriterien zur Diagnostik des M. Osler | |
|---|---|
| klinisches Kriterium | nähere Angaben |
| Epistaxis | spontan, rezidivierend |
| Teleangiektasien | typische Lokalisationen: Lippen, Nase, Finger |
| viszerale Manifestationen | gastrointestinal, pulmonal, hepatisch, zerebral |
| Familienanamnese | Erkrankung eines Elternteils |
Asymptomatische AV-Shunts finden sich zu 50 % in der Lunge, zu 30 % in der Leber und zu etwa 10 % im Gehirn. Da okkulte AV-Shunts Komplikationen wie Rechtsherzinsuffizienz, Schlaganfälle oder Hirnabszesse auslösen können, empfehlen die Experten entsprechende Screening-Untersuchungen. Bei der Lunge sollte alle fünf Jahre ein Screening erfolgen, wobei die kontrastmittelgestützte Echokardiographie für pulmonale arteriovenöse Shunts die optimale Untersuchungsmethode darstellt. Finden sich Shunts, raten die Autoren zur Embolisation. Eine kausale Therapie des M. Osler gibt es bis jetzt nicht. Mit einer Befeuchtung der Nasenschleimhaut können die Betroffenen häufiger Epistaxis vorbeugen.
Betablocker werden derzeit in Studien untersucht
Das gelingt mit weichen Salben oder durch Verschluss der Nase mit hypoallergenem Pflaster. Im Notfall muss eine Tamponade her, wobei die HNO-Ärzte pneumatische Tamponaden mit weicher, gleitfähiger Oberfläche bevorzugen. Sie verursachen bei der Entfernung keine erneuten Schleimhautschäden. Die endonasale Verödung von Osler-Pits gilt ebenfalls als Erstlinientherapie bei HHT-Patienten mit Nasenbluten. Dafür wurde in mehreren Zentren der der Nd:YAG-Laser erfolgreich eingesetzt. Studien zeigen, dass damit Dauer und Häufigkeit von Epistaxis-Episoden deutlich abnehmen. Akute und stärkere Blutungen aus AV-Shunts der Nase lassen sich auch mit Radiofrequenzverfahren schleimhautschonend behandeln. Verschiedene medikamentöse Ansätze befinden sich in der Prüfung. Dazu zählt z.B. der Angiogenesehemmer Bevacizumab, der bei der Behandlung von Magen-Darm-Blutungen und zur Reduktion des Nasenblutens hilfreich sein kann. Auch die antiangiogenetischen Eigenschaften von Betablockern wie Propranolol und Timolol werden derzeit in Studien untersucht. Viele HHT-Patienten hoffen auf die Gentherapie. Doch bis defekte Gene bei ihnen inaktiviert oder ersetzt werden können, dürfte noch intensive Forschung notwendig sein.Quelle: Haubner F et al. HNO 2018; 66: 405-414