CD38-Antikörper verbessert Prognose beim Multiplen Myelom
 Dieser entartete Leukozyt hat einen stark vergrößerten Nucleus (rot) und sehr aktive Mitochondrien (blau) im Cytoplasma (braun).
© Science PhotoLibrary/Gschmeissner, Steve
Dieser entartete Leukozyt hat einen stark vergrößerten Nucleus (rot) und sehr aktive Mitochondrien (blau) im Cytoplasma (braun).
© Science PhotoLibrary/Gschmeissner, Steve
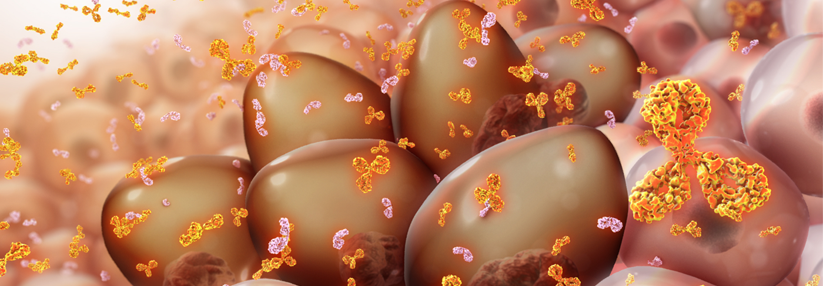
Daratumumab ist ein humaner monoklonaler Immunglobulin Gκ-Antikörper und richtet sich gegen CD38. Gesunde Plasmazellen sowie Zellen des Multiplen Myeloms (MM) exprimieren dieses Oberflächenmolekül, berichtet ein Forscherteam um Professor Dr. Smith Giri von der University of Alabama in Birmingham. Der Antikörper wurde bereits erfolgreich in Kombination mit verschiedenen Backbone-Therapien beim MM eingesetzt. Er verbesserte in Studien das Ansprechen und das progressionsfreie Überleben der Patienten, erklären die Autoren.
Drei bestimmte Alterationen verdoppeln die Mortalität
Nun gingen die Forscher der Frage nach, ob dieser Prognosevorteil auch für Betroffene mit einer zytogenetischen Hochrisikokonstellation gilt. Hierzu identifizierten sie sechs relevante randomisierte Phase-3-Studien, in denen Daratumumab plus ein etabliertes Therapieregime gegen die alleinige Gabe des Standardregimes geprüft wurde, und unterzogen sie einer Metaanalyse.
Je drei Untersuchungen schlossen Patienten mit einem neu diagnostizierten bzw. einem rezidivierten oder therapierefraktären MM ein. Bei 580 der insgesamt 4061 Teilnehmer lag eine zytogenetische Hochrisikokonstellation vor: t(4;14), t(14;16) oder del(17p). Diese genetischen Aberrationen verdoppeln das Sterberisiko, schreiben die Forscher.
Progressionsfreies Überleben um bis zu 55 % verlängert
Die Gabe von Daratumumab in Addition zur Erstlinie verbesserte den primären Studienendpunkt, das progressionsfreie Überleben, signifikant. Und zwar für Menschen mit einem neu diagnostizierten Hochrisiko-MM im Vergleich zur Kontrolle um 33 % (gepoolte Hazard Ratio [HR] 0,67; 95%-KI 0,47–9,95) und für Patienten mit einem rezidivierten oder therapierefraktären Tumorleiden um 55 % (gepoolte HR 0,45; 95%-KI 0,30–0,67).
Zusätzlich berechneten die Wissenschaftler den Effekt bei den Studienteilnehmern mit MM-Standardrisiko. Auch für sie ergab zusätzliches Daratumumab ein signifikant längeres progressionsfreies Überleben – sowohl bei den Patienten mit einem neu diagnostizierten als auch bei denen mit einem rezidivierten oder therapierefraktären Multiplen Myelom (gepoolte HR 0,45; 95%-KI 0,37–0,54 bzw. gepoolte HR 0,38; 95%-KI 0,26–0,56).
Effekt unabhängig vom Backbone-Regime
Die Ergebnisse der Metaanalyse haben eine praktische Relevanz, meinen die Experten: Sie deuten auf einen Prognosevorteil von Daratumumab bei Patienten mit einem Multiplen Myelom mit zytogenetischem Hochrisiko. Dieser Effekt scheint unabhängig von der Art des eingesetzten Backbone-Regimes zu bestehen und sowohl Patienten mit einem neu diagnostizierten als auch Erkrankte mit einem rezidivierten oder therapierefraktären Krebsleiden zu betreffen.
Quelle: Giri S et al. JAMA Oncol 2020; DOI: 10.1001/jamaoncol.2020.4338
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).