Pyoderma gangraenosum ist gefährlich, aber behandelbar
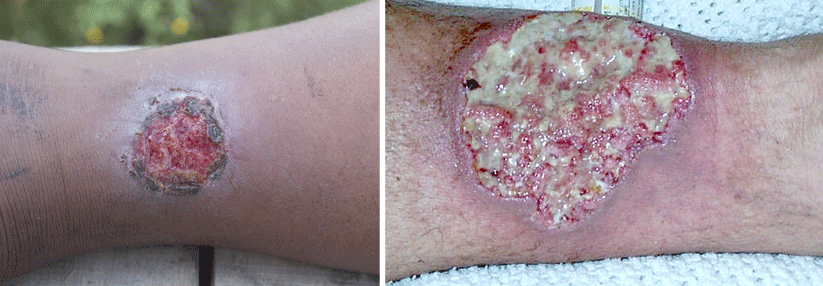
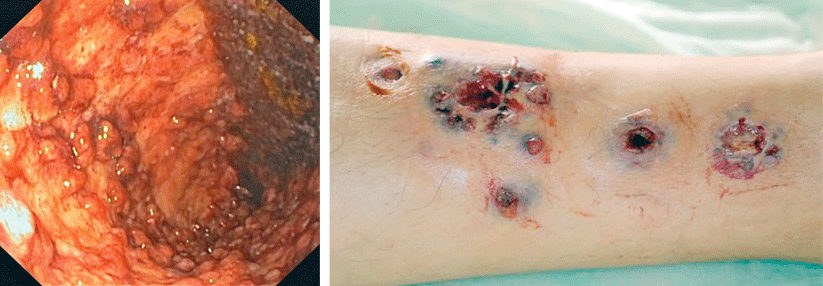
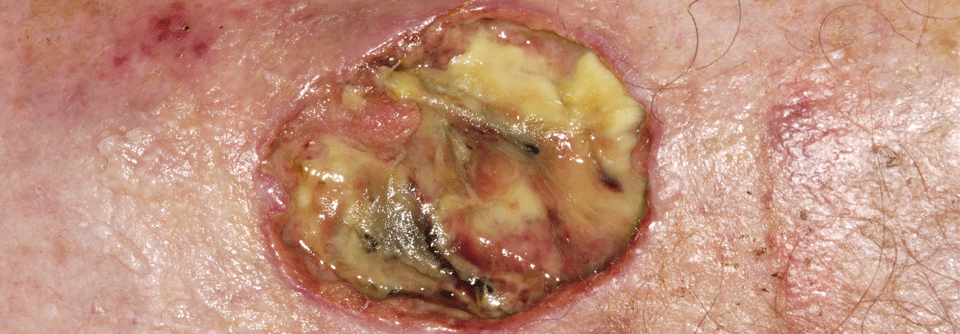
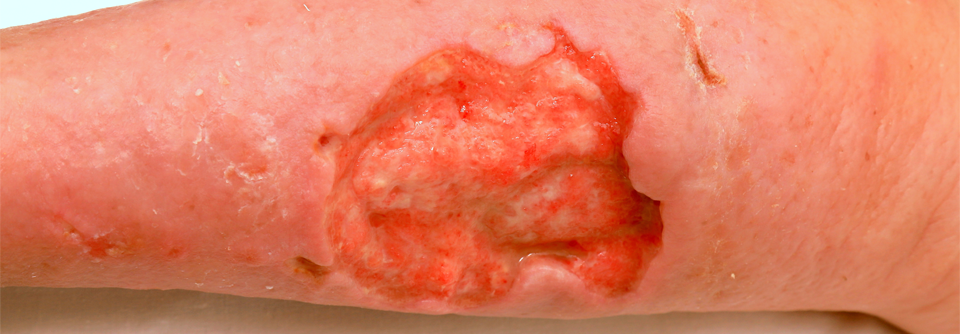
 In der progredienten aktiven Phase umgibt die Ulzera ein livid-rotes Erythem.
© Science Photo Library/Marazzi, Dr. P.
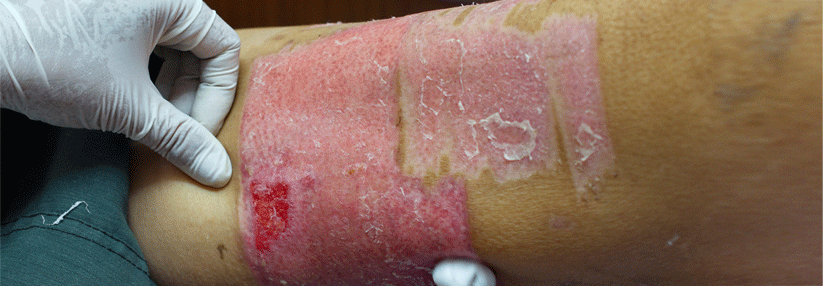
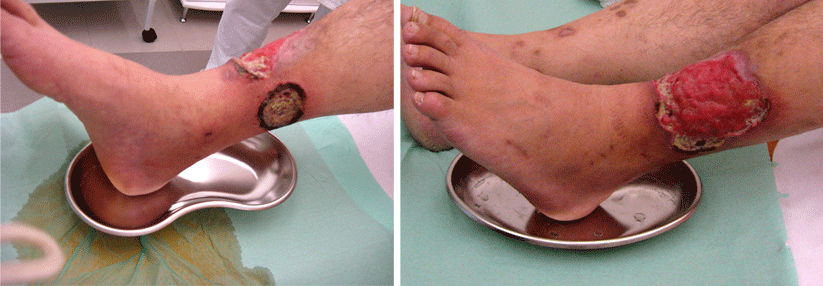
In der progredienten aktiven Phase umgibt die Ulzera ein livid-rotes Erythem.
© Science Photo Library/Marazzi, Dr. P.
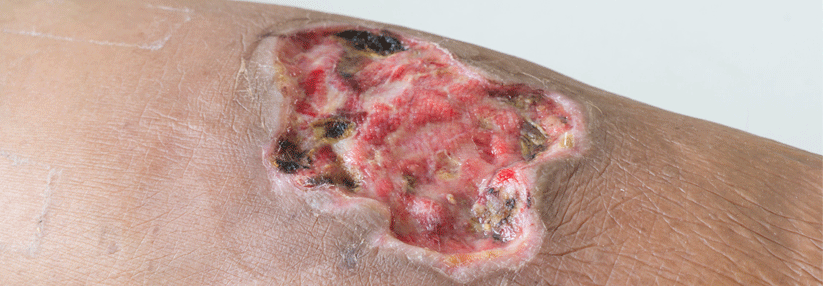
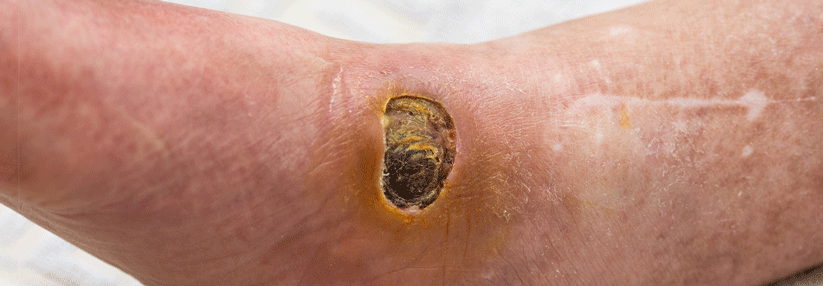
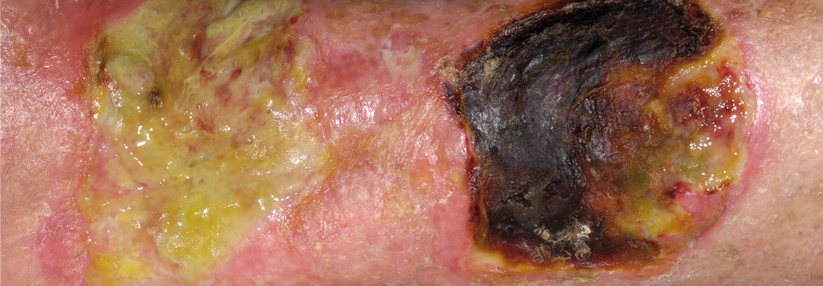
Charakteristisch für das Pyoderma gangraenosum (PG) sind hochschmerzhafte, z.T. bizarr konturierte Ulzerationen mit purulentem oder hämorrhagischem Exsudat und aufgewordenen Wundrändern. Vor allem im aktiven Stadium umgibt die Läsionen ein livid-rotes Erythem. Die vielfach als typisch angesehene Unterminierung findet sich nur in weniger als einem Drittel der Fälle, heißt es in der neuen S1-Leitlinie der DDG. Erkranken können Menschen jeden Alters – Frauen trifft es doppelt so häufig wie Männer. Die vermutlich immunologisch bzw. autoinflammatorisch bedingten Läsionen bilden sich bei bis zu 70 % der Betroffenen an den Beinen (v.a. in der Tibiaregion), aber auch an Stamm, Brust, Kopf und Hals sowie in der Umgebung von Stomata.
| Diagnostik | |
|---|---|
| Basisdiagnostik | weiterführende Diagnostik z.B. bei Therapieversagen, Rezidiv oder Verdacht auf assoziierte Krankheit |
| Blutbild, Leber- und Nierenwerte, CRP, Cholesterin, Triglyzeride, HbA1c, Urinuntersuchung, Blutdruckkontrolle, Ulkusabstrich zum Nachweis einer aktiven Begleitinfektion, Spindelbiopsie | Abdomensonographie, CT, Test auf okkultes Blut im Stuhl, Lymphknotensonographie, Differenzialblutbild, Blutausstrich, Immunfixation und Immunglobuline, Antikörper: ANA, bei Titer > 1:160: ANA-Screen, p-ANCA, c-ANCA, AMA, Rheumafaktoren und ACPA, Apl-Antikörper, Komplementfaktoren (C3 und C4), fäkales Calprotectin, Hepatitis-Serologie, HIV-Test, Frauen: gynäkologische Untersuchung |
Diabetes ist häufigste Komorbidität
Als typsische Provokationsfaktoren fungieren Bagatelltraumata und chirurgische Interventionen, seltener Medikamente. Die Gewebeschädigungen führen über ein Pathergiephänomen zur Läsionsbildung. So erleiden 15 % der Patienten mit vorbekanntem PG postoperativ ein Rezidiv. Das Sterberisiko von Betroffenen ist im Vergleich zur gesunden Bevölkerung dreifach erhöht. Zudem ist Pyoderma oft mit chronisch entzündlichen Darmerkrankungen (CED), rheumatoider Arthritis (beide v.a. bei jungen Patienten), Malignomen oder autoinflammatorischen Syndromen (z.B. PAPA, PASH*) assoziiert. Als häufigste Komorbidität gilt der Diabetes und fast alle PG-Patienten zeigen zumindest Teile des metabolischen Syndroms (Hypertonie, Dyslipidämie etc.).
Die Diagnose ist aufgrund vielgestaltigen Bildes und der Verwechslungsgefahr mit anderen ulzerierenden oder pustulösen Erkrankungen nicht einfach. Sie stützt sich überwiegend auf die Klinik und den Ausschluss von Differenzialdiagnosen. So sollten alle Patienten auf neoplastische und rheumatische Erkrankungen sowie das Vorliegen eines metabolischen Syndroms gescreent werden. Beinulzera erfordern eine gezielte Abklärung auf PAVK und chronisch venöse Insuffizienz. Auch bewusste Selbstverletzungen sehen den Hautmanifestationen mitunter täuschend ähnlich.
Pathergie-Test
| PARACELSUS-Score für Pyoderma gangraenosum | ||
|---|---|---|
| Kriterium | Punkte | |
| Haupt- | progredienter Verlauf | 3 |
| Ausschluss relevanter Differenzialdiagnosen | 3 | |
| rötlich-livider Wundrand | 3 | |
| Neben- | Ansprechen auf Immunsuppressiva | 2 |
| typische bizarre Form der Ulzeration | 2 | |
| extremer Schmerz (VAS > 4) | 2 | |
| lokales Pathergiephänomen | 2 | |
| Zusatz- | suppurative Inflammation in der Histopathologie | 1 |
| unterminierter Randsaum | 1 | |
| assoziierte Systemerkrankung | 1 | |
| Liegt der Gesamtpunktwert ≥ 10, ist ein Pyoderma gangraenosum wahrscheinlich | ||
Welche Therapie ist die richtige?
Therapiegrundlage ist die adäquate Wundversorgung. Im entzündlichen Stadium sollten primär nicht-adhäsive Verbände bzw. welche mit Hydrogel verwendet werden. Zur topischen Schmerztherapie wird ein Morphin-Wundgel (s. Rezept, BtM-pflichtig) empfohlen. Immunsupprimierte benötigen wegen des höheren Risikos für Superinfektionen eine antimikrobielle Lokaltherapie (Polihexanid, Octenidin etc.)Morphinhydrochlorid-Gel 0,1 % zur Wundbehandlung
Natriumedetat 0,1 g
Hydroxyethylcellulose 400 4,5 g
Lavasept-Konzentrat 0,2 ml
Aqua dest. ad 100,0 g Das Gel wird in einer ca. 2 mm dicken Schicht alle 24 h aufgetragen. Die Verordnung erfolgt über ein BtM-Rezept.
Hydrophiles Polihexanid-Gel 0,04 % (NRF 11.131)
Hydroxyethylcellulose 10 000 2,0 g
Aqua ad iniectabilia ad 100,0 g Das dünnflüssigere hydrophile Gel 0,04 % kann alternativ zur häufig verwendeten, aber osmotisch aktiven Polihexanid-Macrogolsalbe (NRF 11.137) verwendet werden, da es weniger schmerzhaft ist.
Ciclosporin auch in der Erstlinientherapie geeignet
Systemisch zählen orale GC nach wie vor zu den Therapeutika der Wahl, da sie in label sind. Für Prednison bzw. Prednisolon wird eine initiale Tagesdosis von 0,5–1 mg/kgKG empfohlen. Falls Schmerz und die livide Verfärbungen des Wundrandes darunter nicht abnehmen, ist eine Steigerung auf bis zu 2 mg/kgKG/d möglich. Das Gleiche gilt bei rascher Progredienz innerhalb der ersten drei Tage, erkennbar an einer Größenzunahme der ulzerierten Fläche um > 30 %. Eine längerfristige Monotherapie mit systemischen GC wird aus bekannten Gründen nicht empfohlen. Außerdem sprechen viele Patienten nur unzureichend auf die rein steroidale Behandlung an oder erleiden bei Dosisreduktion ein Rezidiv. Durch eine frühzeitige Kombi mit steroidsparenden Immunsuppressiva wie TNF-α-Inhibitoren oder Ciclosporin lässt sich dies vermeiden. Der Calcineurininhibitor kann „mono“ oder zusammen mit einem GC angewandt werden – allerdings wie viele andere wirksame Medikamente nur off label. Initial gibt man 2–5 mg/kgKG/d verteilt auf zwei Einzeldosen. Sobald eine deutliche Besserung eintritt, darf die Menge schrittweise reduziert werden. Ciclosporin eigne sich ebenso gut zur Erstlinientherapie wie GC, betonen die Leitlinienautoren. Auch für den Calcineurininhibitor wird eine zeitliche Begrenzung der Therapie z.B. auf 6–12 Monate empfohlen. Falls Patienten auf GC und/oder Ciclosporin nicht (ausreichend) ansprechen, kommen Azathioprin, Mycophenolatmofetil und Methotrexat in Betracht. Alle drei lassen sich solo oder in Kombination mit Steroiden bzw. Ciclosporin (AZA und MFF) einsetzen, generell tritt die Wirkung aber etwas verzögert ein. Die Behandlung mit Azathioprin wird wegen der Nebenwirkungen häufig abgebrochen und MTX kann seinerseits Wundheilungsstörungen auslösen.Wenn in label möglich, TNF-Blocker verordnen
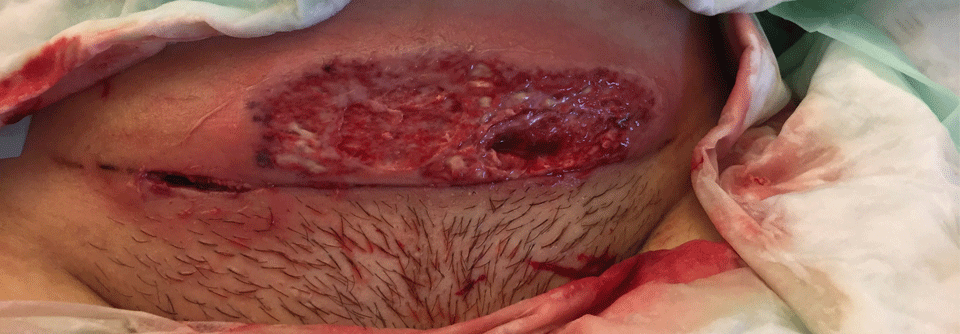
Speziell für Pyoderma-Patienten mit CED oder rheumatoider Arthritis empfiehlt man in der Leitlinie eine frühzeitige (Erstlinien-)Therapie mit TNF-α-Inhibitoren – allein oder in der GC-Kombi. Die Verordnung der Biologika erfolgt bei diesen Patienten im Rahmen der Zulassung. Ansonsten können TNF-Blocker off label eingesetzt werden, wenn GC bzw. Ciclosporin unzureichend wirken oder aus anderen Gründen nicht infrage kommen. Die beste Evidenz existiert für Infliximab. Aufgrund des günstigeren Risiko-Nutzen-Verhältnisses können auch andere TNF-Inhibitoren wie Adalimumab und Etanercept empfohlen werden – Letzteres allerdings nicht bei CED-Patienten. Aufgrund des kurzen Dosierungsintervalls lässt sich die Therapie mit Adalimumab gut steuern, was angesichts der hohen Infektionsgefahr beim PG von Vorteil ist. Theoretisch wären auch Ustekinumab, Anakinra, Canakinumab und weitere Biologika denkbar, die Evidenz ist aber schwach. Zumindest ein klein wenig besser sieht das bei i.v. Immunglobulinen (IVIG) aus. Sie werden bei PG-Patienten mit maligner Grunderkrankung wegen der fehlenden Immunsuppression schon in der ersten oder zweiten Linie eingesetzt. Zudem kommen sie in Betracht, wenn Steroide, Ciclosporin bzw. TNF-Inhibitoren alleine nicht helfen oder nicht anwendbar sind. Mit Ersteren lassen sich IVIG auch kombinieren. Die OP-Indikation darf bei Pyoderma-Patienten wegen des Pathergieeffekts nur zurückhaltend, bei ausreichender immunsuppressiver Behandlung und engmaschiger Kontrolle gestellt werden. In diesen Fällen ist ein chirurgisches Débridement möglich. Spalt- oder Vollhauttransplantationen können die Abheilung der Ulzerationen deutlich beschleunigen.* PAPA: Pyogene Arthritis, PG, Akne; PASH: PG, Akne, Hidradenitis suppurativa
Quelle: S1-Leitlinie Pyoderma gangrenosum, AWMF-Register-Nr. 013-091, wwww.awmf.org
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).