Morbus Crohn und Colitis ulcerosa: Was wissen wir bisher über die Darmerkrankungen?
 Genau erklären lassen sich die Entstehung und der Verlauf von Morbus Crohn und Colitis ulcerosa noch nicht.
© iStock/ipopba
Genau erklären lassen sich die Entstehung und der Verlauf von Morbus Crohn und Colitis ulcerosa noch nicht.
© iStock/ipopba
Verdauen und gleichzeitig Immunzellen beherbergen: Für den Darm ein Balanceakt. Denn bei der Pathogenabwehr darf die Reaktion auf Nahrungsmittelantigene und mikrobielle Darmflora nicht überschießen. Bei chronisch-entzündlichen Darmerkrankungen (CED) gerät dieses komplexe System dauerhaft aus dem Lot.
Crohnpatienten mangelt es an Becherzellen
Auch wenn immer mehr Details bekannt werden: Genau erklären lassen sich die Entstehung und der Verlauf von Morbus Crohn und Colitis ulcerosa (CU) noch nicht. So sind im Genom bisher zwar mehr als 240 Risiko-Loci beschrieben, die offenbar mit CED in Zusammenhang stehen. Sie erklären aber nur bis zu 13 % der Variabilität der einzelnen Krankheiten, berichtet Professor Dr. John Chang von der University of California San Diego in La Jolla.
Unterschiede gebe es nicht nur zwischen Erkrankten und Gesunden, sondern beispielsweise auch zwischen verschiedenen Subtypen des Morbus Crohn. Ein Schwachpunkt ist für den Gastroenterologen momentan noch die Methodik. Er vermutet, dass man bislang vor allem stark exprimierte Gene in den häufigsten Zelltypen erfasst hat. Mithilfe von Techniken, die Analysen einzelner Zellen bzw. Subtypen zulassen, könnte man möglicherweise neue therapeutische Ansätze oder Biomarker identifizieren.
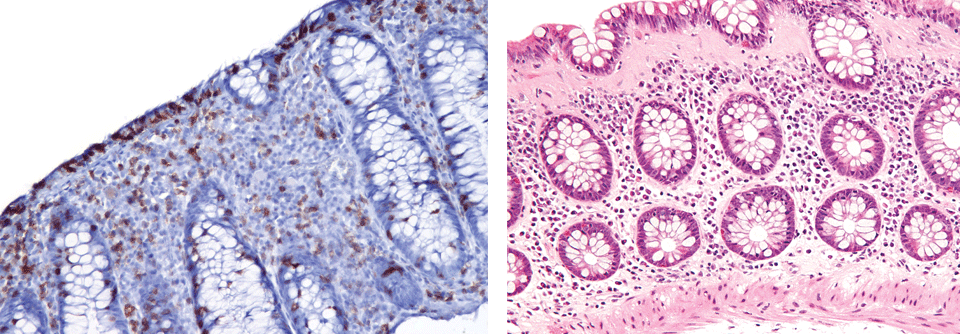
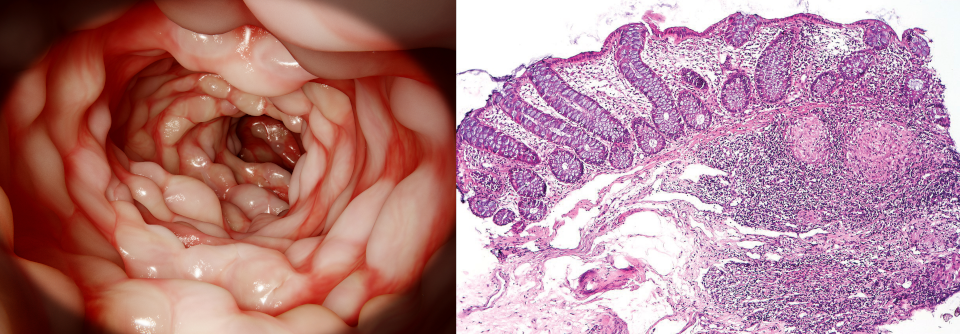
Auffällig ist die geschwächte Barrierefunktion des Darmepithels, insbesondere der Mukosa. Bei Morbus Crohn hängt das vermutlich an der geringeren Anzahl schleimbildender Becherzellen, bei der Colitis ulcerosa scheinen diese eher fehlreguliert zu sein. Auch die Zellen des Epithels hängen nicht mehr eng genug zusammen. Dadurch kann das sonst so wichtige Mikrobiom Probleme bereiten: Bakterien dringen in das Epithel ein und lösen dort Abwehrreaktionen aus. Zudem scheint die Artenvielfalt der mikrobiellen Gemeinschaft und deren Menge zu schwinden – was mit vermehrten Entzündungen einhergeht. Eventuell kann es durch die Gabe von Bakterien gelingen, diese Reaktionen zu beeinflussen. Allerdings ist nicht immer klar, welche der zahlreichen Immunreaktionen, die in der Mukosa, dem Darmepithel und dem darunter liegenden Bindegewebe ablaufen, im Rahmen der CED tatsächlich relevant sind.
In bis zu 50 % der Fälle wirken Biologika nicht dauerhaft
Die vorhandenen Wirkstoffe greifen an verschiedenen Stellen an. Doch auch wenn zum Beispiel Biologika in vielen Fällen helfen, sprechen drei von zehn Patienten nicht auf sie an – und bei bis zu 50 % der übrigen Behandelten geht die Wirkung mit der Zeit verloren.
Ein weiteres therapeutisches Ziel könnte die Antikörperproduktion durch B-Zellen darstellen. Wie Prof. Chang erklärt, gibt es Hinweise darauf, dass Plasmazellen im entzündeten Darmgewebe weniger IgA und/oder vermehrt IgG produzieren. Ein möglicher Ansatzpunkt wäre, wieder eine Dominanz von IgA herzustellen, wie sie bei Gesunden vorherrscht.
Auf der Ebene der T-Zellen führt die Unterdrückung Interleukin-12- und -23-vermittelter Signalkaskaden dazu, dass Typ-1- und Typ-17-Immunreaktionen gehemmt werden. Dazu nutzt man spezifische Antikörper, aber auch Januskinase-Inhibitoren wie Tofacitinib. Unwirksam seien dagegen Antikörper gegen IL-17 geblieben. Möglicherweise, so Prof. Chang, weil damit auch positive Effekte wie die Abwehr von Pilzen oder Reparaturmechanismen blockiert werden. Im Darm unterdrücken u.a. regulatorische T-Zellen die Typ-17-Immunreaktion. Trotz vieler offener Fragen sucht man auch auf dieser Ebene nach möglichen Therapien, die die Differenzierung und Funktion der regulatorischen T-Zellen fördern.
Gedächtniszellen im „Inflammationsmodus“
Zu guter Letzt bringt der Experte noch die Gedächtniszellen ins Spiel. Gewebegebunden werden sie aktiv, sobald Erreger über die Oberflächen eindringen. Ihre Anzahl ist bei CED erhöht und bestimmte Typen dieser Zellgruppe scheinen vermehrt im „Inflammationsmodus“ zu arbeiten. Zumindest in Tierversuchen ging dies mit einer größeren Durchlässigkeit der intestinalen Barriere einher. Zudem wandern zytotoxische T-Zellen aus dem Gewebe und zirkulieren im Körper – eine mögliche Erklärung dafür, warum CED-Patienten oft auch extraintestinale Symptome entwickeln.
Quelle: Chang JT. N Engl J Med 2020; 383: 2652-2664; DOI: 10.1056/NEJMra2002697
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).
Verwandte Links
- Pathophysiology of Inflammatory Bowel Diseases Chang JT. N Engl J Med 2020; 383: 2652-2664