B-Zell-Lymphome: die Qual der Wahl
 An Behandlungsmöglichkeiten mangelt es bei Lymphomen nicht.
© Dr. N. Lange – stock.adobe.com
An Behandlungsmöglichkeiten mangelt es bei Lymphomen nicht.
© Dr. N. Lange – stock.adobe.com
Gentechnologie, Antikörper, Small Molecules oder Immunmodulatoren – neben der klassischen Chemotherapie stehen mittlerweile viele weitere Ansätze für die Behandlung von B-Zell-Neoplasien zur Verfügung. Das eröffnet neue Möglichkeiten, allerdings fehlen häufig noch konkrete Empfehlungen zur Verwendung dieser Präparate.
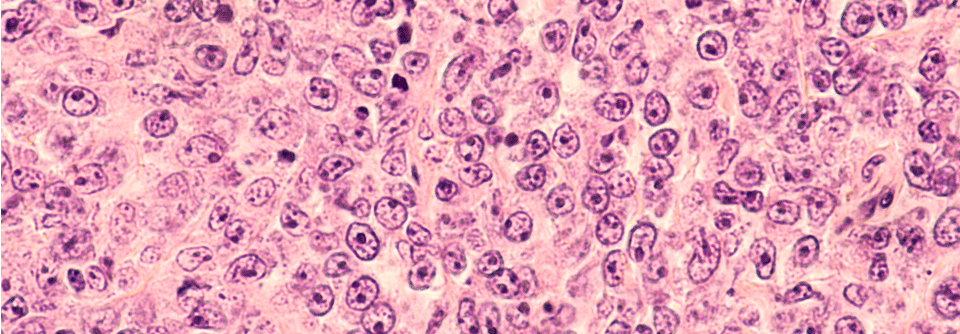
Diffuses großzelliges B-Zell-Lymphom
Beim diffusen großzelligen B-Zell-Lymphom kommen „die Neuen“ zum Einsatz, wenn die initiale R-CHOP(Rituximab, Cyclophosphamid, Doxorubicin, Vincristin , Predniso(lo)n, Prednisolon)-Immunchemotherapie nicht zur Heilung führt. Vor allem die CAR-T-Zellen haben hier laut Professor Dr. Kami Maddocks von der Ohio State University eine besondere Bedeutung.1 „Sie bieten eine Möglichkeit für Patienten, die auf eine Salvage-Therapie nicht ansprechen oder nach autologer Stammzelltransplantation ein Rezidiv bekommen“, erklärte sie. Nach Axicabtagen-Ciloleucel und Tisagenleclecel stehe seit März 2021 auch Lisocabtagene Maraleucel dafür zur Verfügung.
CAR-T-Zellen führten in den Zulassungsstudien bei etwa 40–60 % der Patienten zu einem Komplettansprechen, und das habe bei 30–40 % von ihnen auch zwei Jahre später noch bestanden. Nach Ansicht der Expertin belegen diese Zahlen, dass die Behandlungen kurativ sein können. Im Weg stehen der Therapie allerdings die Kosten und Nebeneffekte wie Zytokinfreisetzungssyndrom und neurologische Toxizitäten. „Diese waren zwar reversibel, erforderten aber die Behandlung in einer Spezialklinik.“
Auch für Erkrankte, die bei einem Rezidiv nicht für die Salvage-Therapie und autologe Stammzellen infrage kommen, könnten CAR-T-Zellen eine Option bieten – nach anderen Therapien. „Für diese Patienten sehe ich mittlerweile Tafasitamab plus Lenalidomid als bevorzugtes Regime an“, sagte Prof. Maddocks. Auf die Kombination aus dem CD19-Antikörper und dem Immunmodulator sprachen in der L-MIND-Studie 60 % an, insgesamt 43 % vollständig. Langzeitdaten belegten außerdem, dass die Response fast drei Jahre anhielt, bei einem medianen Gesamtüberleben von annähernd 32 Monaten.
Bei Betroffenen, die das Duo nicht vertragen, würde die Ärztin Bendamustin plus Rituximab (BR) ergänzt durch den CD79B-Antikörper Polatuzumab erwägen – was sonst erst als Drittlinienoption vorgesehen ist. Gegenüber BR allein verlängerte diese Kombination in der Zulassungsstudie das mediane progressionsfreie Überleben (PFS) von 3,7 Monaten auf 9,5 Monate und das Gesamtüberleben (OS) von 4,7 Monaten auf 12,4 Monate. Zudem habe ein Viertel der Behandelten mehr als zwei Jahre später noch auf die Therapie angesprochen, „was darauf hindeutet, dass ein Teil der Patienten eine dauerhafte Remission erreichen kann“, so ihre Bewertung. Vor einer CAR-T-Behandlung solle man allerdings lieber ein anderes Schema nutzen, da Bendamustin negative Effekte auf die T-Zellen habe.
Als weitere Möglichkeit nannte Prof. Maddocks das im April 2021 in den USA zugelassene Loncastuximab-Tesirin. Es habe mit 48 % ein relativ hohes Ansprechen, wenn auch im Median nur für zehn Monate. Daher sei es auch als Überbrückungstherapie interessant. Den oralen Wirkstoff Selinexor empfahl sie dagegen nicht. Ihn würde sie nur für Patienten nutzen, bei denen die anderen Behandlungen nicht wirken und die auch für klinische Studien nicht infrage kommen.
Chronische Lymphatische Leukämie
Bei der chronischen lymphatischen Leukämie (CLL) befindet sich die Erstlinie derzeit im Wandel. Die bisher übliche Immunchemotherapie bleibe aber zumindest für jüngere Patienten unter 65 Jahren mit Mutation in den variablen Segmenten der Immunglobulinschwerkettengene (IGHV) sowie 13q-Deletion weiterhin eine Option, berichtete Dr. Deborah Stephens, Huntsman Cancer Institute, University of Utah.2 Bei diesen Patienten wirkte die Kombination aus Fludarabin, Cyclophosphamid und Rituximab über viele Jahre hinweg besser als bei Patienten mit unveränderten IGHV. Zudem war sie genauso gut wie der BTK-Inhibitor Ibrutinib plus Rituximab. „Man muss aber betonen, dass 5 % der Probanden eine akute myeloische Leukämie oder ein myelodysplastisches Syndrom entwickelten, was natürlich eine lebensbedrohliche Komplikation darstellt“, gab die Expertin zu bedenken.
Für eine Vielzahl an Patienten seien die BTK-Inhibitoren vor allem Ibrutinib, grundsätzlich gut geeignet. Unter Regimen, die diese Substanz enthielten, schritt die Erkrankung langsamer voran als unter BR. Ob man Ibrutinib mit Rituximab kombiniert oder nicht, machte in der entsprechenden Studie jedoch keinen Unterschied. „Daher empfehle ich Rituximab in Kombination mit Ibrutinib in der Erstlinientherapie normalerweise nicht“, so Dr. Stephens. Ähnliches gelte für den BTK-Inhibitor Acalabrutinib und den CD20-Antikörper Obinutuzumab. Ausnahmen bilden Situationen, in denen Effekte schnell nötig seien, z.B. unkontrollierte autoimmune Zytopenien oder rasante Progression der CLL.
Welchen BTK-Inhibitor man verwenden sollte, hänge auch vom Patienten ab. Ibrutinib punktet durch längere Follow-up-Daten und eine geringere Anfälligkeit für Infektionen – mit Ausnahme von Aspergillus-Infektionen. Acalabrutinib verursacht geringere Nebenwirkungen und eignet sich besser bei Erkrankten über 80 Jahren, bei Vorhofflimmern oder chronischem Nierenversagen. Es müsse aber zweimal täglich genommen werden und wirke nicht, wenn der Patient noch mit einem PPI behandelt wird, betonte Prof. Stephens. Bei gleichzeitiger Antikoagulation mit Warfarin riet sie wegen des Blutungsrisikos von beiden BTK-Inhibitoren ab. Außerdem könnten beide eine Hypertonie verursachen, die mit der Zeit schlimmer würde.
Für Menschen, die schon unter Bluthochdruck leiden oder nicht dauerhaft Krebsmedikamente schlucken möchten, greift die Expertin eher zu Venetoclax plus Obinutuzumab. Die Studien dazu laufen noch, demonstrieren aber, dass der Bcl-2-Hemmer eine tiefe Remission induzieren könne, was therapiefreie Zeiten erlaubt. Allerdings müsse man die Patienten in Echtzeit auf Toxizitäten wie das Tumorlyse-Syndrom überwachen. „Anderenfalls würde ich einen BTK-Inhibitor empfehlen.“
Fortgeschrittenes follikuläres Lymphom
Beim refraktären oder rezidivierten follikulären Lymphom bringen BTK-Inhibitoren offenbar keinen Benefit, wie Professor Dr. John Seymour vom Peter MacCallum Cancer Centre in Melbourne erläuterte.3 Sei der Rückfall mehr als zwei Jahre nach der Initialtherapie aufgetreten und keine Transformation festzustellen, habe man die Wahl zwischen einer erneuten Chemotherapie mit Rituximab und dem sogenannten R2-Schema aus Rituximab plus Lenalidomid – wobei die Daten beim follikulären Lymphom eher für R2 sprächen. In entsprechenden Subgruppenanalysen sei es beim PFS mit median 39 Monaten vs. 14 Monate überlegen gewesen.Wenn nötig, kann man eine Drittlinie mit Tazemetostat oder PI3-Kinase-Inhibitoren anschließen.
Ist das EZH2 mutiert, bevorzugt Prof. Seymour Tazemetostat – damit falle die Zytoreduktion deutlicher aus. „Wählt man einen PI3-Kinase-Inhibitor, sind Zweckmäßigkeit der Verabreichung und Nebenwirkungsprofil wegweisende Faktoren“, so der Experte. Er persönlich präferiere Umbralisib. Daneben habe man noch Idelalisib und Duvelisib sowie Copanlisib, das i.v. gegeben werde, zur Verfügung. Sie wirkten beim follikulären Lymphom gleich gut, sagte Prof. Seymour, „mit Ansprechraten zwischen 40 % und 60 % und ähnlicher -dauer, und mit einem medianen PFS im Bereich von neun bis zwölf Monaten.“
Auch die Nebeneffekte wie T-Zell-vermittelte Immunreaktionen, Neutropenie und opportunistische Infektionen ähnelten sich. Unter Umbralisib liege die Rate der autoimmunen Reaktionen jedoch niedriger und man müsse die Therapie seltener unterbrechen.
„Über den genauen Stellenwert der CAR-T-Zell-Therapien beim follikulären Lymphom bin ich mir noch nicht im Klaren“, berichtete Prof. Seymour. Laut einer Studie liege die Ansprechrate auf Axicabtagen-Ciloleucel bei 94 %, mit einer vollständigen Response von 84 %. Bedenken habe er vor allem wegen Kosten, Aufwand und neurologischen Komplikationen. Letztere träten bei sechs von zehn Behandelten auf, umfassten auch Delire und blieben teilweise irreversibel bestehen. Bestätige sich jedoch der Nutzen, könnte diese Therapie im Algorithmus weiter nach vorn rücken.
Quellen:
1. Maddocks KJ et al. 2021 ASCO Annual Meeting (virtuell); Incorporating Novel Agents Into Management of Relapsed Diffuse Large B-Cell Lymphoma: How to Choose and Sequence Among New Options
2. Stephens DM et al. 2021 ASCO Annual Meeting (virtuell); Selecting Optimal Upfront Therapy in Patients With Chronic Lymphocytic Leukemia
3. Seymour JF. et al. 2021 ASCO Annual Meeting (virtuell); Targeted Therapy of Indolent B-Cell Lymphomas: How to Incorporate New Therapies
Kongressbericht: 2021 ASCO Annual Meeting (virtuell)
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).